文|氨基观察
当出海成为必答题,所有人都在看着,中国原研创新药的国际化征途走到了哪一步?
过去几年,从BTK抑制剂泽布替尼、CAR-T疗法西达基奥仑赛,再到PD-1替雷利珠单抗,一个个选手的成功突围,意味着中国原研创新药开始与世界接轨。不过,严格来说,当前还只是出海的上半场。
替雷利珠单抗们的出现,论证了中国药企能够做出兼具品质、创新的好药;然而,未摘掉的“低价”标签,仍是掣肘中国药企海外定价和商业化的重要因素。
换句话说,中国原研创新药行业还需更进一步,才能开启出海下半场。
药企的成长与生态环境相辅相成。中国原研创新药要想撕掉“低价”标签,需要更多企业走出内卷怪圈,也需要政策层面给予更多支持,例如在“价格保护”方面做得更好。

实际上,药企出海的意义不仅仅是与全球接轨,也是整个行业真正形成良性的创新循环、惠及更多患者的关键。说白了,这也是我国生物医药产业实现“从大到强”的必经之路。
如今,原研创新药出海浪潮越来越猛烈,这些问题的解决显得愈发迫切。
01、出海答卷日渐清晰
过去创新药出海之所以进展较少,是客观原因造成的。不同的监管、商业化环境,导致出海对所有中国药企都是一个全新、复杂的考验。如今,随着先行者们的逐步探索,出海答卷已经日渐清晰:过硬的产品质量、世界级研究数据、全球布局的临床注册能力。
过硬的产品质量是根本。在全球性3期头对头研究中,泽布替尼对比第一代BTK抑制剂伊布替尼,取得显著的优效性结果,这使得泽布替尼备受认可成为Best in class;西达基奥仑赛的临床数据,也预示着其拥有更好的疗效和安全性数据,最终在与Abecma的对垒中可以不占劣势地位。而首个出海的PD-1替雷利珠单抗也具有差异化竞争优势,其分子设计旨在最大限度地减少与巨噬细胞中的 Fcγ受体结合,具有显著增强抗肿瘤活性的特点。
世界级研究数据则是必选项。这要求药企从立项一开始就高标准、严要求,以国际化视角去设计实验方案并贯彻执行。这也是替雷利珠单抗成为首个顺利出海的国产PD-1的核心原因。
可以看到,此次替雷利珠单抗欧洲上市的依据RATIONALE 302研究,入组了来自欧洲、亚洲和北美洲11个国家和地区共132个研究中心的513例患者。实际上,除了提供RATIONALE 302研究的临床数据,百济神州共提供了7项临床试验中,1972例接受替雷利珠单抗单药治疗患者的安全性数据。
全球临床注册能力,决定着出海的效率与进度。国际多中心临床入组地点较多,对药企的研发团队及运营团队有着极高的要求,不仅要严格把握国际准则、入组患者的入排标准、试验质量控制,还要非常熟悉海外临床注册法规的各项要求。
替雷利珠单抗能够后来居上,正是因为百济神州全球临床注册羽翼已丰。从2015年起就开始和全球监管打交道,百济神州积累了丰富的全球临床注册经验。泽布替尼已累计在全球超过65个国家及地区获批,在欧美等主流发达国家实现广泛覆盖的同时,也已在多个新兴市场上市。
这些能力最终在替雷利珠单抗的身上也得到了延续。替雷利珠单抗的全球临床开发绝大部分都由百济神州推进。除了疫情因素,百济神州的出海很少遇到“延迟”的情况。
某种程度上,越来越多的成功出海案例传递出的积极信号是,面对一个全然陌生的市场,中国药企已然能够走得越来越稳妥。这也意味着,中国原研创新药的出海大潮正加速来袭。
02、加速良性创新循环
对于以传奇生物、百济神州为代表的创新药企而言,一旦进入全球市场,将会加速形成良性创新循环,有能力惠及更多患者。
一方面,出海能为药企带来稳定的现金流回报,毕竟欧美市场在政策、供给、价格及支付体系方面,都营造了良好的环境。
不管是泽布替尼还是西达基奥仑赛,都已证明海外商业化环境能够创造相当可观的收益。今年上半年,泽布替尼美国收入高达25.19亿元,带动百济神州收入大幅增长72%,达到72.5亿元;西达基奥仑赛海外收入也达到了1.89亿美元,上半年销售额已超去年全年。接下来,替雷利珠单抗大概率也是如此。
更重要的是,出海能够获得更高的利润空间。根据百济神州总裁、首席运营官吴晓滨透露,替雷利珠单抗未来在海外的定价和国内不会一样,将参考海外支付能力。目前,K药在美国年治疗费用超过17万美元,而替雷利珠单抗在国内年治疗费用不足1万美元。
很显然,如果成功撬动海外市场,处于“卷王”赛道的替雷利珠单抗,仍将为百济神州带来极为显著的业绩增量,加速公司走向盈利节点,也有能力投入更多资源在创新研发层面。
另一方面,出海能为药企获取海量真实世界患者数据,让药企洞见更为真实的临床需求,从而满足更多临床未满足的需求。
因为真实世界的情况复杂程度远超注册试验入选的患者。只有通过真实世界数据的积累、研究,才能更充分了解不同治疗方案对病人的治疗效果,为药企带来更多研发思路,从而为患者带来更多获益。
显而易见的一点是,随着中国药企海外商业化的推进,稳定的现金流回报和大量的真实世界患者数据,能够进一步反哺创新研发,加速蜕变,最终实现良性循环发展。这也将进一步助力我国医药产业的升级。
不过,在此之前仍有一些关键问题需要得到解决,整个行业也需要一场务实主义的胜利。
03、亟需撕掉“低价”标签
何为务实主义?对于中国原研创新药来说,实现商业化变现,形成闭环是整个行业良性发展的基础,也是属于创新药的务实主义。
从跟随、反超,再到希望引领发展,中国创新药行业已经进入关键阶段。在这一背景下,要想获得突破性发展,就必须解决一些问题,比如亟需撕掉的“低价”标签。
“低价”标签在PD-1领域体现的最为明显。如下图所示,PD-1在国内市场的定价,中国药企的原研药价格均不足K药、O药的50%。
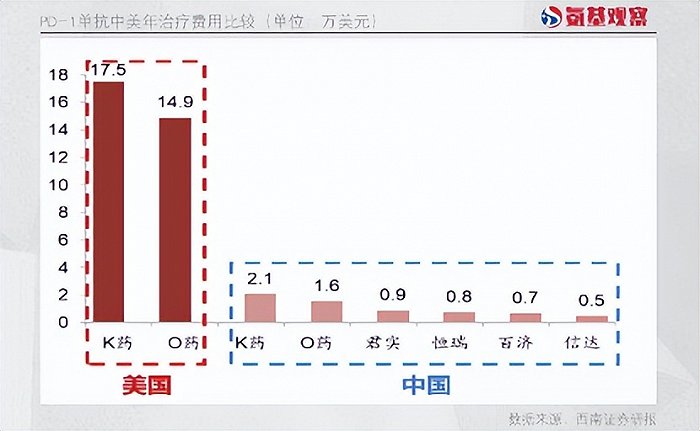
而如果与K药、O药在海外的定价相比,差距则更为明显,价差甚至超过90%。固然,低价很大程度上能够惠及更多患者,但创新药行业并不能“唯低价论”。过低的药价反而会反噬创新生态,影响出海等战略的顺利推进。
毕竟,中国作为原创国,药品的国内价格往往被视为海外市场的价格基础,国内过低的价格一定程度上导致,创新药品在海外市场失去定价主动权,影响了本土创新药出海的定价和市场拓展。
从长远角度来看,“低价”标签的存在,实际上影响着整个行业良性发展闭环的达成。
沿着旧地图,找不到新大陆。只是,撕掉“低价”标签的过程不是一蹴而就的,而是需要多方的共同努力。
一方面,需要企业走出内卷怪圈,真正做到以临床未满足需求为导向进行创新药的开发,从源头上避免内卷,减少价格战的可能;
另一方面,也需要监管的持续探索。只有真正做到了“价格保护”,才能最大程度上促进出海等创新生态的繁荣,造福更多患者。这一点,在海外创新药发展过程中已经得到了充分验证。
包括美国、日本、欧洲等国家地区,对于高临床价值创新药都有着符合其国情的价格保护政策。比如日本,创新药的利润可根据创新性、疗效、安全性等调整,这使得小野制药在日本对纳武利尤单抗的定价,超过百时美施贵宝在美国定价的两倍。也正是这些激励政策,让日本药企在免疫疗法、ADC等诸多创新领域,在全球都具有极高的竞争力。
即使是在严格控制药价的法国,为了推动创新、促进投资和出口,两年前法国也对部分药价管控条款进行了大幅修改。比如,在满足公共健康需求的同时,推动某些改良型药品(ASMR 4级)接轨欧盟价格;由于生产费用可能会造成一定的供应问题,允许某个治疗领域整体或部分药品可以维持较高价格;在ASMR5级药品上市的前三年中,固定其价格等等。
回到国内来说,探索符合国情的价格保护机制也必然非常关键。例如在支付环节,除了老生常谈的商保,也可以探索支付创新试点,建立基于临床价值(疗效)的创新药支付新机制;探索建立多方共付新机制,给予创新药企更自主的定价空间。
甚至,还包括更多政策的探索,比如医保支付标准的“保密”做法。在美国保险公司与代表支付方的药品福利管理公司(PBM)与药品生产企业进行价格谈判后,支付价格通常作为商业机密不对外公布。
在不少人眼中,中国创新药行业仍有许多不足,但成长是显而易见的。如今,站在产业崛起的时代背景下,行业各方需要努力,加速下半场的到来。




评论