文|氨基观察 郑晓
IL-15,曾被视为癌症免疫治疗领域中最有前景的靶点之一。
作为一种刺激性细胞因子,其在临床前研究中对抑制肿瘤生长和抗转移特性表现出显著效果。
也正因此,IL-15在癌症免疫治疗研究中备受瞩目。早在2008年,美国国家癌症研究所就将其列为最具潜力的候选药物。
然而,新药研发的道路并非坦途。由于IL-15半衰期较短,导致其在疗效与安全性之间难以取得平衡。直至2024年,才真正迎来了破冰者。
4月22日,ImmunityBio宣布FDA批准了Anktiva(N-803),联合卡介苗用于治疗对卡介苗无反应的非肌层浸润性膀胱癌伴原位癌患者。

N-803的获批上市,标志着它成为IL-15激动剂领域的先驱,也将激励更多药企在这一赛道上加速前行。
总体来看,有效性、安全性和半衰期是IL-15激动剂研发和优化的三大关键因素。在这三者间找到平衡点,是实现药物成功的关键。
也就是说,IL-15激动剂的研发之路远未结束。随着更多药企的发力,属于IL-15激动剂开发的黄金时代,正缓缓拉开帷幕。
01 免疫系统“激动剂”
作为一种多效性细胞因子,IL-15在免疫系统的发育和维持中扮演着关键角色,能够通过多种机制促进NK细胞和CD8+ T细胞的存活与增殖。
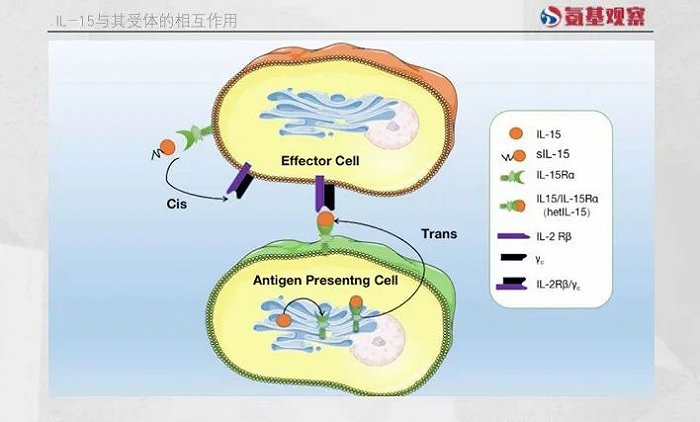
首先,IL-15能够刺激抗凋亡蛋白Bcl-2的表达,帮助防止细胞死亡,从而提高NK细胞和CD8+ T细胞的存活率。
其次,IL-15能够促进与细胞增殖密切相关的蛋白Ki67的表达,推动NK细胞和CD8+T细胞的快速分裂和数量增加。
NK细胞和CD8+T细胞是免疫系统中重要的细胞毒性细胞,能够识别并杀死肿瘤细胞。因此,它们的数量增加和活性提升,直接增强了对肿瘤的免疫打击能力。
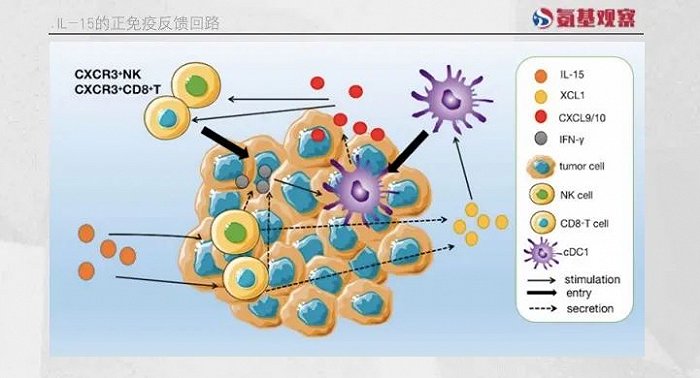
IL-15的作用不仅限于此,研究发现,IL-15激活的肿瘤浸润NK细胞和CD8+ T细胞会上调名为XCL1的趋化因子的分泌。
XCL1能够招募常规I型树突状细胞(cDC1)至肿瘤组织,cDC1具有强大的交叉呈递抗原的能力,有效激活肿瘤引流淋巴结中的初始CD8+ T细胞,促使其进入肿瘤病灶协同杀伤肿瘤细胞,进一步增强抗肿瘤效果。
此外,活化的NK细胞和CD8+T细胞分泌的IFN-γ能刺激cDC1分泌CXCL9和CXCL10,这些因子能将外周的CXCR3+NK细胞和CD8+T细胞吸引至肿瘤组织,形成免疫正反馈回路,维持对肿瘤的免疫监视。
同时,IL-15在肿瘤微环境中对维持记忆T细胞的稳态存活、增殖激活以及维持效应细胞毒性T淋巴细胞(CTL)具有重要作用。记忆T细胞的形成,能够增强免疫系统对肿瘤复发的快速响应能力。
此外,目前的研究已表明,IL-15能够增强抗体依赖性细胞介导的对NK细胞的细胞毒性作用,以及增强免疫疗法的功效。
综上所述,IL-15作为一种有前景的免疫治疗剂,不仅直接增强免疫细胞的战斗力,提高其渗透肿瘤微环境的能力,还能与药物分子结合或构建多功能分子,产生协同作用,提高治疗效果。
因此,IL-15激动剂作为潜在的癌症免疫治疗剂,受到医学界的广泛关注。数据现实,全球已启动近200项使用不同IL-15药物治疗癌症的临床试验。
02 从理想到现实
将理论转化为实践的过程中,往往充满了挑战和不确定性。
最初,医学界主要通过重组技术开发了第一代IL-15激动剂——重组人白细胞介素-15(rhIL-15)。
rhIL-15是一种在大肠杆菌中产生的约13kDa的非糖基化IL-15单体。2015年发表的rhIL-15首次人体I期临床试验结果显示,在转移性恶性黑色素瘤或转移性肾细胞癌患者中,rhIL-15的抗肿瘤效果并不理想。
首先,从疗效角度来看,rhIL-15的表现并不理想。通过静脉推注(IVB)连续12天给药,虽然在一定程度上增加了外周血中的NK细胞和CD8+T细胞数量,但在18例患者中未观察到任何客观缓解,最佳结果仅为疾病稳定。
其次,rhIL-15的毒副作用较强。在该临床试验中,观察到剂量依赖性毒性反应,包括发热和寒战、血小板减少症和低血压。
尽管后来通过皮下注射的方式改善了rhIL-15的毒副作用,但疗效问题仍然难以解决。
核心问题在于rhIL-15的半衰期较短,导致其在体内迅速被清除。如果频繁且大剂量给药,可能导致毒性问题;如果剂量降低控制安全性,效果方面又难以突破。
为了克服rhIL-15的缺点,研究人员采取了两种主要的优化策略:一是对IL-15本身进行突变或修饰,这是蛋白质药物常见的修饰策略;二是开发IL-15/IL-15Rα复合物。这两种策略都旨在提高药物分子的活性和稳定性。
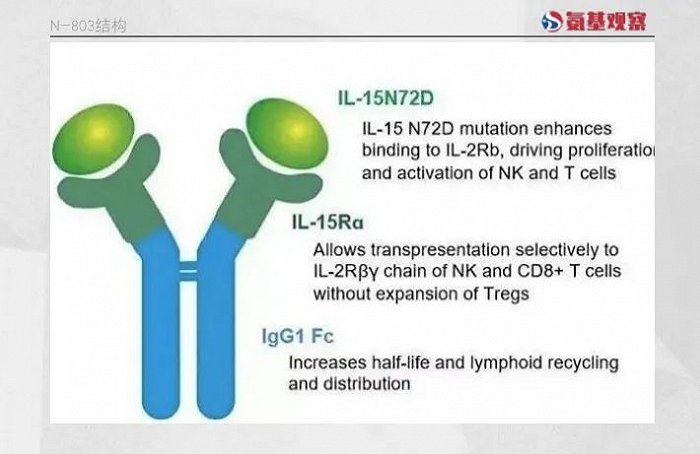
N-803正是在这一阶段率先取得突破的候选药物。作为一种IL-15超激动剂复合物,N-803由IL-15突变体(IL-15N72D)、IL-15Rα sushi结构域和IgG1 Fc融合蛋白组成。IL-15Rα sushi结构域的设计使得N-803能够绕过天然IL-15所必需的反式呈递方式来激活下游信号通路,而IgG1 Fc片段显著延长了药物的半衰期。药代动力学分析显示,N-803的半衰期约为7.2-8小时。
在与卡介苗(BCG)联合治疗的临床研究中,N-803展现了良好的潜力。在针对160例BCG无反应性非肌层浸润性膀胱癌(NMIBC)患者的联合治疗中,无论是伴有或不伴有乳头状肿瘤(CIS队列)的患者,均显示出71%的完全缓解率,中位持续时间为24个月。在非CIS队列中,1年时的无病率为57%,2年时为48%。
总体而言,大部分患者(CIS队列中91%,非CIS队列中95%)能够暂时避免进行膀胱切除术,并且联合治疗的安全性良好,没有报告与治疗相关的严重副作用。
正因为这些积极的临床结果,FDA批准了N-803联合卡介苗治疗BCG无反应性NMIBC的适应症上市。N-803由此成为IL-15激动剂领域的先驱。
03 步入黄金时代
历时十几年,IL-15激动剂终于迎来了破冰者,但N-803的上市并不是IL-15激动剂领域探索的终点,而是标志着该领域进入了发展的黄金时代。
可以看到,基于上述理念对IL-15激动剂进行改造的药企不在少数,且它们的方法存在一定的差异性。
例如,Nektar公司设计的NKTR-255是一种新型的重组人IL-15(rhIL-15)聚乙二醇(PEG)偶联物,它保留了与所有受体结合的能力,并维持了IL-15的全部生物学特性。与rhIL-15相比,NKTR-255展现出了更优的药物动力学特性,其半衰期达到了15.2小时。
这一领域,也出现了一些创新的设计,几种新的靶向/多功能IL-15激动剂正在研发之中。
例如,pro-IL-15是首个采用前药设计策略的IL-15激动剂分子。该药物基于IL-15-IL-15RαSu-Fc结构,通过N端的MMP-14可切割肽连接子将IL-15Rβ的胞外结构域连接起来形成pro-IL-15。Pro-IL-15阻断了IL-15的结合位点,使其在外围循环中失活。
该理念的目的是,在富含基质金属蛋白酶(MMP)的肿瘤微环境中,肽连接子被酶切除,导致IL-15Rβ脱落,从而恢复分子的活性。
HCW Biologics公司则开发了双功能分子HCW9218。这是一种含有可溶性TGF-βRII和IL-15/IL-15RαSu的异二聚体融合蛋白,能够中和TGF-β(抑制肿瘤进展和缓解免疫抑制),同时直接激活免疫细胞。
在这场IL-15研发竞赛中,国内药企也没有缺席,包括恒瑞医药、博际生物、奥赛康在内的公司都参与其中,布局相关管线。
那么,最终哪家公司能够脱颖而出呢?




评论