文|经纬创投
前几天,一篇新研究发布在《自然医学》(Nature Medicine)杂志上,科学家们证实了一个针对阿尔兹海默症(AD)的结论——当载脂蛋白E的基因出了bug,你就有很大风险会得阿尔兹海默症,有五分之一的阿尔兹海默症患者,是由遗传因素引起的。
这项新研究主要针对ApoE4。以前的研究就发现,ApoE4是与阿尔兹海默症高度关联的危险基因,但一直未能证实他们的因果关系。ApoE是指载脂蛋白E,它将胆固醇输送到全身和大脑,被认为在沉积或清除粘性β淀粉样斑块方面,发挥着作用,而粘性β淀粉样斑块,是阿尔兹海默症的标志之一。
一个人可以携带三种类型的ApoE基因。一种名为ApoE2的蛋白,被认为可以预防阿尔兹海默症的发展,ApoE3被认为具有中性的疾病风险,而ApoE4几乎是一颗“定时炸弹”。
如果你带有一个ApoE4的基因(从父母中的一位继承而来),这将会使你的阿尔兹海默症发病率增加30%。如果你同时有两个ApoE4基因(从父母双亲身上同时继承到两个这样的基因),这会令发病率升高到50%以上(不同研究的论文中得出其发病率为50%~90%)。而在没有ApoE4基因的人群里发病率较低,只有9%。
阿尔兹海默症一直是人类有待攻克的重要疾病,至今还没有弄明白它的发病机制到底是什么,直到去年才有药物上市,但疗效也相对有限。分子生物学和神经科学在20世纪之后取得了一波又一波的突破性进展,生物学家已基本厘清了高度复杂的癌症发病机制,并找到了许多阻止癌症恶化的方法。而在神经与脑科学方面,根据与思维和情感相关的脑化学/脑电反应过程及其特点,已经发明了虽不完美但有效的药物,用于治疗抑郁症、精神分裂症、焦虑症和双向情感障碍等。
尽管这些药物还有待深入研究和改进,但在应对这些疾病的过程中,我们至少知道研究方向是否正确,而阿尔兹海默症则完全不是这样的。尽管我们有一些对发病机制的研究结果,但它们都还属于假说,未被证实,并且当制药公司以这些假说为基础研制新药时,绝大多数结果都令人沮丧。
今天这篇文章,我们就来介绍一下这篇新研究的结果,它可能会扩大治疗方法(包括基因疗法)的范围,影响临床试验的设计。并且在这篇文章中,还会梳理一下医学界目前对阿尔兹海默症的研究,到了哪一步?至今有哪些药物突破?最后我们列出一位专业医生给出的应对建议,希望大家可以更了解阿尔兹海默症,并对生活中患有这种可怕疾病(不同阶段)的朋友,予以尽可能的关怀与帮助,Enjoy:
- 这次有什么新发现?
- 有哪些药物突破?
- 一些医生给出的专业建议
01 这次有什么新发现?
在上文中,我们介绍了ApoE4与粘性β淀粉样斑块之间的关系,在这次的新研究中,来自西班牙和美国的科研人员,就是在临床研究中(近3300个大脑数据,以及来自1万名临床试验参与者的数据),将拥有两个ApoE4基因的人,与拥有其他形式ApoE基因的人进行了比较。
研究发现,拥有两个ApoE4基因的人,不仅更有可能发生导致阿尔兹海默症的生物学变化,而且他们几乎可以确定诊断:这种有两个ApoE4基因的案例,在82岁时出现阿尔兹海默症的生物学症状的几率高达95%。
但并不是所有出现这种生物学症状的人(在大脑中形成粘性β淀粉样斑块),都一定会导致阿尔兹海默症。在极少数情况下,ApoE4基因携带者的大脑中会出现大量粘性β淀粉样斑块,但却不会出现症状,这可能是因为其他遗传或环境因素保护了大脑,但具体是什么原因,还有待探索。
此外,当有两个ApoE4基因的人出现症状时,往往出现的时间更早,平均而言会早出现10年(65岁左右)就患上阿尔兹海默症。
基于这些结果,该研究的主要作者巴塞罗那 Santa Creu i Sant Pau 医院神经内科记忆组主任胡安-福尔特亚(Juan Fortea)博士与其合著者认为:拥有两个ApoE4基因,应被视为阿尔兹海默症的一种遗传形式,而不仅仅是一个风险因素,因为拥有两个 ApoE4基因,确实推动了疾病的进程。
阿尔兹海默症的发病机制非常复杂,至今我们还没有真正证实其原因。面对这个疾病,好像大自然用人们无法看见的墨水书写了“规则”,但当我们真正开始研究之后,这些“规则”又被重新涂改了。
最早,研究人员在实验室的老鼠身上,看到了似乎非常确凿的证据,矛头指向一种叫β-淀粉样蛋白堆积所生成的斑块,这种黏性蛋白斑块最终导致突触被损害,进而引发阿尔兹海默症。多年以来,国际一流医学杂志上发表了大量这方面的研究论文,全球医学机构与新药研发公司也积极筹款用于这类研究。
但当制药公司尝试以“淀粉样蛋白理论”为基础研制新药时,结果却令人费解而沮丧。临床实验中,人脑并没有像“规则”所阐述的那样,对这些药物产生反应。而且如果只是这些药物应有的功能失效,那倒可以理解,但事实并非如此。在很多情况下,这些实验性药物都基本达到了研究者的初衷,似乎是符合“规则”的,但患者的病情不但没有好转,反而有时候会出现不可思议地恶化,这就好像火箭发射一切都按设计执行,但却在发射前夕突然爆炸了一样。

目前,医学界对于阿尔兹海默症的发病机制,主要有3种主流假说,依据信号通路上下游顺序,它们分别是:
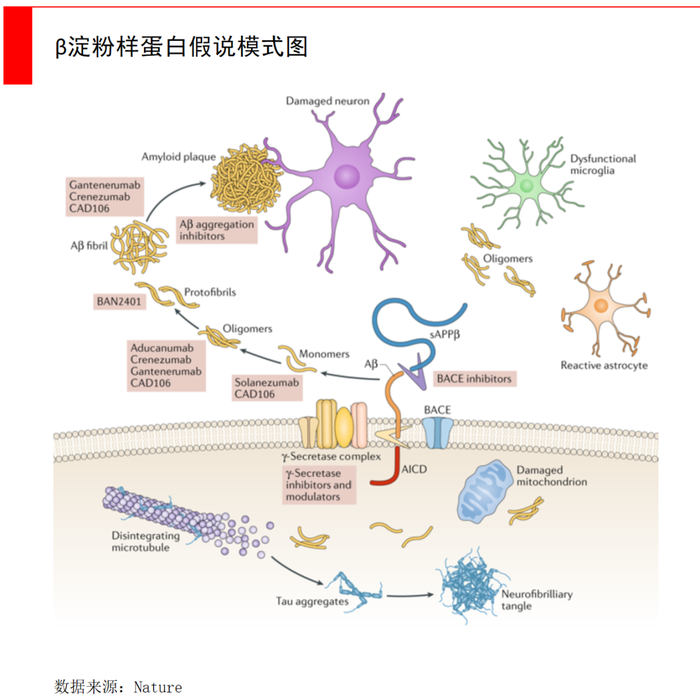
第一,淀粉样蛋白级联假说:这个假说认为β类淀粉样蛋白(Aβ)在脑内沉积,是致病的核心环节,可引发一系列病理过程,并且进一步促进Aβ沉积,从而形成一种恶性放大反应。
目前来看,几款重要药物,例如渤健的Aducanumab、lecanemab和礼来的Donanemab,都是靶向Aβ淀粉样蛋白的AD药物,为Aβ假说提供坚定支撑。
第二,Tau蛋白磷酸化假说。这个假说认为,病理状态下,患者脑内Tau蛋白过度或异常磷酸化,使其丧失促微管组装的生物学活性,微管解聚、轴突运转出现障碍,进而引起神经细胞的凋亡,导致阿尔兹海默症发生。Tau蛋白的磷酸化与AD患者病程中认知功能缺失密切相关。
第三,胆碱能假说。该假说认为阿尔兹海默症的产生,是由于患者脑内的神经递质存在缺陷,导致胆碱能神经元受到损伤。乙酰胆碱酯酶(AChE)和乙酰胆碱转移酶(ChAT)的活性下降是乙酰胆碱(Ach)浓度下降、胆碱能活性下降的主要原因。
如果从患者数量角度来说,根据《The China Alzheimer Report 2022》的数据,目前中国60岁以上痴呆症患者约为1507万人,其中阿尔兹海默症(AD)患者约为983万人,血管性痴呆(VD)患者392万,其他痴呆132万患者,阿尔兹海默症是老年痴呆最主要形式。同时老龄化加剧使得AD成为突出的社会问题,到2030年,我国AD患者人数将突破2000万人,他们都非常需要有效的药物。
当然,除了ApoE4之外,还有一些与阿尔兹海默症更强关联的基因被人类发现,比如PSEN基因等等,有些甚至会99%-100%导致阿尔兹海默症。不过可以松一口气的是,这些基因在人群中的表达量非常低,基本上处于1%以下甚至更低。
02 有哪些药物突破?
2023年,阿尔兹海默症治疗药物迎来突破。
其实往前看2年,在2021年卫材/渤健的Aducanumab就获得了FDA批准,打破了此前美国近20年无阿尔兹海默症新药上市。但Aducanumab由于实验结果矛盾、临床获益不明确等问题,受到市场质疑。
直到2023年,有两款更有效的药物出现,让阿尔兹海默症治疗药物终于迎来突破。
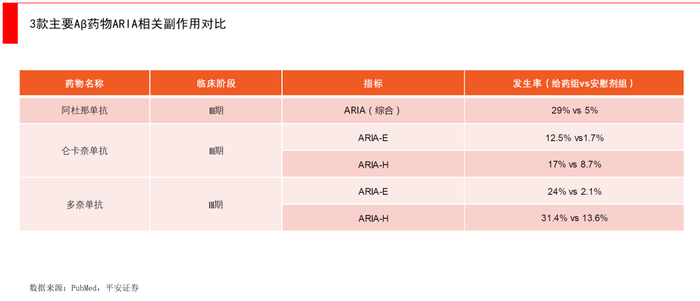
第一款是Lecanemab(仑卡奈单抗)。卫材/渤健的Lecanemab在2023年7月获得FDA的完全批准。相比于之前争议较大的Aducanumab,仑卡奈单抗与Aβ低聚物以及原纤维结合能力更强,更能特异性靶向患者体内的Aβ。
在全球III期临床研究中,与安慰剂相比,Lecanemab减缓了评估患者认知和日常功能的综合评分、临床痴呆评定量表总评分(CDR-SB)的27%增加速度,达到主要临床终点。
据平安证券,在美国市场,仑卡奈单抗一年疗程的治疗费用为26500美元,具体花费会根据患者体重的不同浮动。美国联邦医疗保险计划,将覆盖这款产品全部用药费用的80%。
在中国,2023年10月仑卡奈单抗已正式通过海南省药品监督管理局审核,落地海南博鳌乐城国际医疗旅游先行区。在海南乐城上市的仑卡奈单抗规格为200 mg/2 ml,价格为3328元/瓶,在说明书中,仑卡奈单抗的推荐剂量为10 mg/kg,每两周使用一次。据此测算,一个体重为60 kg的患者,需要的药量为600 mg,约3瓶药物,单次使用花费约9984元,月治疗费用约为2万元,年治疗费用约24万。
另一款是Donanemab,这款药后来居上,对Tau蛋白中低表达患者疗效显著。2023年7月,礼来宣布了阿尔兹海默症新药多奈单抗Donanemab的完整III期临床数据。共有1736名早期阿尔兹海默症患者,在接受为期18个月的治疗后,根据iADRS评分量表,多奈单抗可使早期患者的认知功能下降速度减缓22%。
其中针对Tau蛋白中低表达的患者,下降速度减缓更为显著,为35%,达到预设临床终点。根据CDR-SB评分量表,多奈单抗可使患者的认知功能下降速度减缓29%。其中针对Tau蛋白中低表达的患者,下降速度减缓36%。在轻度认知障碍及低中度Tau蛋白表达人群中,患者iADRS与CDR-SB减缓达60%与46%。以上结果表明,多奈单抗可显著减缓早期阿尔兹海默症患者认知下降,且在部分人群中有更为突出的疗效。不过礼来的Donanemab还没有拿到FDA的获批,预计会延期到今年下半年。

此外,一些新治疗方法正在被探索。减肥药司美格鲁肽也被认为有一定潜在效果,即GLP-1受体激动剂可能有助于阿尔兹海默症治疗。
阿尔兹海默症也被称为“3型糖尿病”,其危险因素主要包括糖尿病、胰岛素抵抗、衰老。在既往研究中发现,阿尔兹海默症患者存在脑胰岛素抵抗,可能与AD的认知减退有关。临床初步表明GLP-1R有保护AD患者认知功能,GLP-1R激动剂或通过神经保护作用,改善认知及记忆。
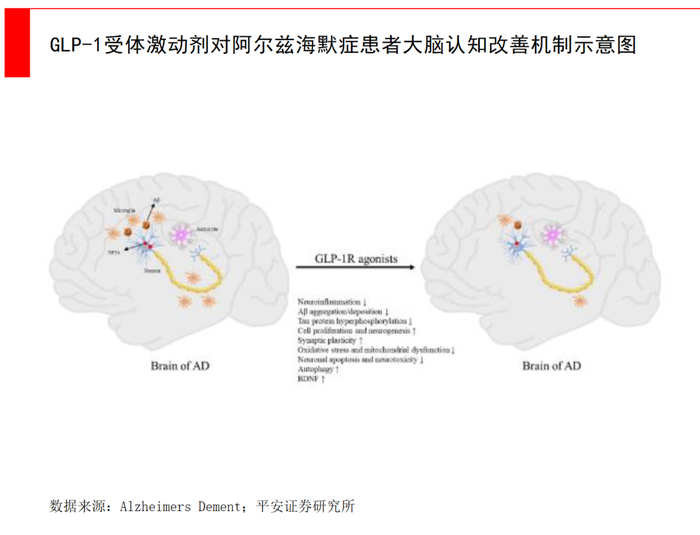
诺和诺德在大型随机对照试验中发现,服用GLP-1药物的患者可以降低53%的痴呆发生率,并在临床前研究中发现,司美格鲁肽能够提高小鼠记忆力、减少p-tau积聚。
当下,口服司美格鲁肽用于阿尔兹海默症治疗的全球III期临床试验正在开展。在GLP-1药物治疗AD的适应症领域,全球有两项口服司美格鲁肽对比安慰剂,正处于III期临床研究阶段,这两项研究各纳入1840人,预计2025年完成主要临床终点。
如果成功,那司美格鲁肽将大大拓展适应症,在已有的减肥概念下,如果还能治疗阿尔兹海默症,那将成为一款载入史册的“神药”。

03 一些医生给出的专业建议
由于医学界还没有研发出可靠的治疗手段,所以在最后,我们想奉上一份由专业医生写的应对AD的策略指南,作者Dr. Marc E. Agronin是一名老年精神病学家,也是Frank C. and Lynn Scaduto Mind Institute at Miami Jewish Health的首席医疗官,这篇文章刊登在华尔街日报上。当然,以下只是一些应对策略,而非治疗方法,具有一定的主观性,仅供参考。

预防是关键:你需要了解随着年龄增长,会产生的导致脑损伤的风险,尤其是高血压、糖尿病、抑郁症、吸烟、过量饮酒、听力损失、肥胖、久坐不动的生活方式、社会隔离、一些危险活动造成的脑损伤、对衰老的消极态度等等。尽快解决这些问题,并结合有益大脑的健康生活方式,可以降低风险并改善健康状况。
关注一些相关指标:随着年龄的增长,需要将短期记忆能力、寻词能力和其他大脑能力视为认知方面的重要指标,就像血压这样的指标一样,需要定期测量和监测。虽然这些能力随着年龄的增长而发生变化是正常的,但它们也可能反映出压力、睡眠、焦虑、抑郁、药物因素等方面的问题,而这些问题都是可以扭转的。如果这些变化持续存在并不断加剧,则可能是阿尔兹海默症的先兆。
及时看医生:阿尔兹海默症非常复杂,即使我们掌握了所有指标,诊断也可能难以捉摸。不要忽视早期症状,也不要等到症状严重到无法忽视时才去就医。要积极主动,一有认知改变的迹象就去寻求帮助,比如老年精神科医生或神经科医生,进行全面评估。
积极应对:保持脑部活跃,想方设法享受生活。你不需要放弃任何生活,除非这会造成风险。很多病人在治疗后依然会继续旅行、与朋友和家人交往,并从事他们一直喜欢的兴趣爱好,但会稍作调整。
积极乐观:虽然当面对阿尔兹海默症时,可能很难做到积极乐观。但根据科学研究,拥有良好的心态、自信心和目标感,对于降低阿尔兹海默症的患病风险,和改善确诊后的健康状况大有裨益。护理人员可以通过提供同理心和鼓励正常感来帮助改善态度。专注于自己能做的事情,而不是屈服于自己不能做的事情。
归根结底,我们都走过了同样的大脑衰老之路,都会带来神经认知的变化,包括记忆力衰退和认知能力下降等等挑战。对于那些面临阿尔兹海默症的患者来说,我们的认知和治疗方法已经远远超过了几年前的水平,并且科学有望在未来几年为我们带来更多进步,保持乐观。
References:
1.NYT:Study Suggests Genetics as a Cause, Not Just a Risk, for Some Alzheimer’s
2.NYT:Mutation Protected Man From Alzheimer’s Disease, Hinting at Treatment
3.CNN:Genes known to increase the risk of Alzheimer’s may actually be an inherited form of the disorder, researchers say
4.WSJ:The New, More-Hopeful Face of Alzheimer’s Disease
5.平安证券:阿尔兹海默症(AD)全景图:Aβ药物打开AD新世界大门,诊疗市场有望双双点燃
6.华创证券:阿尔兹海默症诊断专题,治疗手段突破催化诊断行业变革
7.戴尔·E.布来得森:《终结阿尔兹海默病》



评论