文|氨基观察
过去十年,创新医疗器械行业上演了一幕幕产业与资本的协奏曲:产业架桥、资本开路,共同创造了从无到有的奇迹,颠覆者层出不穷。
然而,资本市场的慷慨解囊,在推动创新的同时,也加速了行业内卷。许多国内企业在产品开发上,似乎都在遵循一种“差不多”的策略:
从立项之初,就未将超越现有技术作为目标;而是满足于开发一些短期内能带来财务回报的“勉强可用”产品。
虽然不能一概而论,但这一现象确实存在。无论是心脏瓣膜还是神经介入,这些看似高端的领域,也未能幸免于内卷的漩涡。
曾经的颠覆者,也难逃被颠覆的命运。市场预期的破灭,资本的退潮,导致企业估值的大幅缩水。

创新医疗器械行业,无疑需要一场深刻的供给侧改革,扭转这一颓势。眼下,转机或许已经出现。
最近,健世科技TTVR产品的上市遇阻,可能是供给侧改革已经启动的一个信号。企业们是否已经做好了准备,迎接这场改革的洗礼?
01 创新桥头堡
在心脏瓣膜领域,经导管三尖瓣置换产品无疑是国产医疗器械创新的桥头堡。
三尖瓣返流是由三尖瓣无法完全闭合引起的,会导致心脏收缩期血液从右心室倒流到右心房的情况。长期来看,三尖瓣返流会导致右侧郁血性心力衰竭,症状包括外周水肿、腹水及郁血性肝病变。
在传统的治疗手段中,药物与传统外科三尖瓣介入是核心治疗手段。但药物相对来说起到控制的作用,且作用相对有限,因此手术是最后的补救手段。
但传统的外科手术,由于侵入性太大,对老年人和高风险患者不大又好,因此需要更安全有效手术治疗方式的面世。
在TAVR之后,包括爱德华等全球企业,也都瞄准了经导管三尖瓣介入修复/置换产品的研发。相对于传统外科手术,经导管三尖瓣介入修复/置换产品在安全性方面拥有无可比拟的优势。
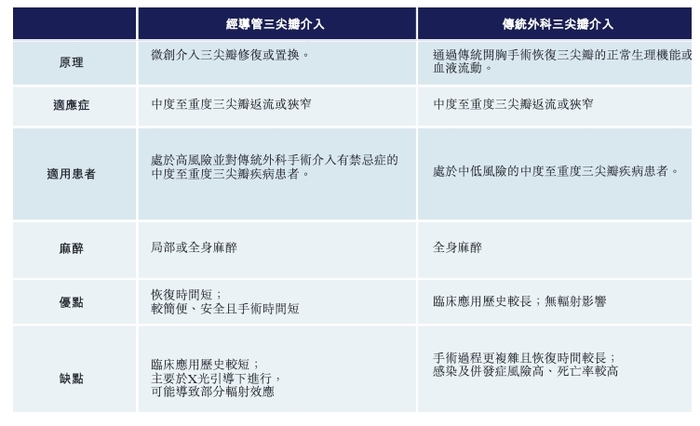
相比于大部分医疗创新产品,国内企业在经导管三尖瓣介入置换产品的研发上,走在全球前列。
健世科技的LuX-Valve,是世界上首个完成确证性临床试验受试者入组的在研产品,公司也是预期,其将成为全球首批获批准用于商业化的经导管三尖瓣置换产品之一。
在招股书中,健世科技描绘了LuX-Valve的畅想图:预计2023年将有600名患者接受经导管三尖瓣介入的收入治疗,2030年将增长至20.09万名。
也正是基于LuX-Valve的预期,健世科技完成了港股上市。当然,不管临床上是否能够完成患者数量激增的目标另说,LuX-Valve的首要任务是拿证上市。
遗憾的是,LuX-Valve上市的目标搁浅了。
02 倒在了审批环节
从临床数据来看,LuX-Valve的性能确实给人留下深刻印象。
一年的随访数据显示,有99.1%的患者三尖瓣返流情况得到了改善,94.4%的患者三尖瓣返流程度降低至轻度或更轻微,而75.7%的患者更是恢复到了无返流或微量返流的状态。
在这一年的观察期内,全因死亡率为10.32%;发生三度房室传导阻滞或需要植入永久性起搏器的患者比例仅为1.6%,发生卒中的比例为2.4%,而肺梗塞和瓣膜支架断裂的发生率均为0。
综合这些数据,可以认为LuX-Valve在确证性临床研究的一年期结果中表现出了卓越的疗效和安全性,不仅显著改善了患者的三尖瓣返流症状,还显著提升了患者在术后的身体状态和生活质量。
那么,LuX-Valve又为什么折戟呢?LuX-Valve的临床试验设计可能正是其遭遇挫折的关键所在。根据媒体报道,公司表示否决理由是,该类产品无法确认权威的单组目标值。
原来,该产品采用了单组目标值设计的临床试验,其主要评估终点是一年内的累计死亡率。据媒体报道,公司方面表示,遭到否决的理由是该类产品无法确立一个权威的单组目标值。
单组设计,也就是单组目标值试验设计,指的是在试验中只设立一个试验组,而不设置对照组。通过连续纳入符合条件的病例,并进行试验器械的干预,来评估试验器械的疗效。然后将试验器械的疗效与预先设定的目标值进行比较,以此来评价试验器械是否达到了预设的疗效目标。
这种设计相对简单,但由于缺少了同期对照组,单组试验设计存在固有的偏倚风险,比如非同期对照偏倚,由于时间和空间上的不一致,可能会引起选择偏倚、混杂偏倚、测量偏倚和评价偏倚等问题。
关于单组目标值设计,国家药品监督管理局医疗器械技术审评中心曾明确指出,在临床试验设计中,随机、设盲、平行对照的设计能够提供更高等级的科学证据,应当被优先采用;而单组目标值设计只在特定条件下才会被考虑接受。这表明监管机构倾向于更有说服力的临床试验设计,以确保医疗器械的安全性和有效性。
LuX-Valve目前面临的问题,最终导致了其遭到否决。如果确实如公司所说,问题出在临床设计上,这或许反映了监管机构对于“单组目标值”设计的更加严格的要求。
03 LuX-Valve折戟启示录
当然,无论LuX-Valve是否因为临床设计的问题而在审批环节遭遇挫折,这一事件都为我们带来了重要的启示。
在医疗器械领域,海外巨头之所以能够崛起,很大程度上得益于它们对技术创新的不懈追求和对产品质量的严格要求。巨头们通过持续的研发投入,不断推出具有突破性的产品,满足了市场的高标准需求,从而赢得了市场的认可和尊重。
对于国内医疗器械企业来说,要想在竞争激烈的市场中立足,就必须在产品开发上做得更好。这意味着企业需要不断追求技术上的突破,提高产品的创新性和竞争力;同时,也要在工艺上不断精进,提升产品的性能和质量。
此外,在临床试验的设计和执行上,企业也应对自己提出更高的要求。临床试验是验证医疗器械安全性和有效性的关键环节,其结果直接关系到产品的审批和上市。因此,企业应该选择科学合理的临床对照产品,确保临床试验的严谨性和科学性,以高质量的临床数据支撑产品的审批。
只有持续挑战更高的目标,不断推动产品的创新和优化,企业才能推出更高质量的产品,从而在激烈的市场竞争中避免被颠覆。
换言之,对于国内创新医疗器械行业来说,供给侧改革不应仅仅是政策层面的推动,更应由企业自身发起,自我革命,这才是“内卷”该有的样子。




评论