文|氨基观察 武月
一生九死,是对创新药研发最好的概括。
根据BIO等组织发布的关于药物临床开发成功率的报告,其在统计完9704个药物的1.27万个临床开发项目后发现,2011年至2020年十年间,药物开发项目从1期临床到获得FDA批准上市的成功率平均为7.9%,所需要的时间平均为10.5年。
RNAi药物的出现,打破了这一生九死的局面。
由于根据碱基互保配对原则,RNAi药品开发类似编程,相比小分子或单抗等生物制剂开发成功率,高得不是一点半点。RNAi领头羊Alnylam的临床转化成功率(1期到3期累计)高达64.3%,并且,目前全球获批的5款RNAi药物原研皆出自Alnylam之手。
RNAi让我们处在了一个新的时代入口。当然,尽管其机制和成功率具有颠覆性,但更多选手还处在证明自己的阶段。

换句话说,Alnylam超高的临床成功率背后,既离不开RNAi药物机制的本身优势,更离不开自身的奋斗。
正如其创始CEO Maraganore的总结,“找到解决方案的道路从来不是一条直线,达到目标的关键在于韧性、遵循科学的引导,以及培育追求创新的环境。”
01 超高临床转化率
“Alnilam”是猎户座腰带中明亮的中心恒星,数千年来一直被用于航海导航的“宇宙灯塔”,这就是Alnylam公司名称的由来。
经过几十年的研发奋斗,Alnylam终于让自己成为了RNAi领域的灯塔。
自2002年成立,在2018年之前,Alnylam仍未上市第一款产品。而自2018年推出全球首款siRNA疗法ONPATTRO后,Alnylam实现了几乎每年一款新药的获批上市。
至今,Alnylam已获得了五种RNAi药物的批准,包括patisiran、vutrisiran、givosiran、lumasiran(与诺华合作开发)和inclisiran。
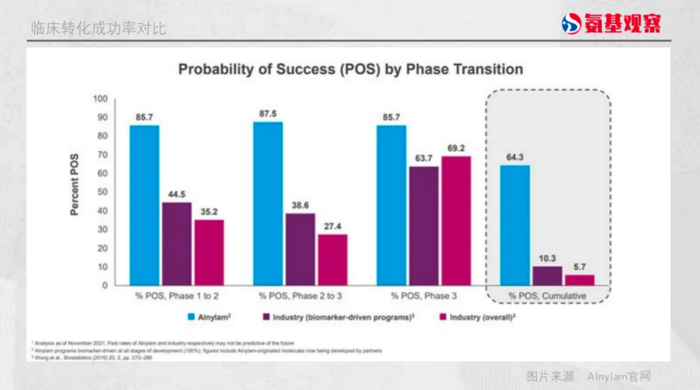
最重要的是,Alnylam实现了极高的临床转化率。根据其披露的数据,在临床1期至3期阶段,其累计转化率达到64.4%,而靶向药领域、医药行业整体的转化率分别只有10.3%和5.7%。
也就是说,其相比整个行业5.7%的累计转化率,高出了11倍。
如下图所示,在不同临床阶段,Alnylam都能实现85%以上的转化率。而行业内2期临床到3期临床的成功率最低,只有27.4%,最终累计下来,转化率只有5.7%。创新药研发一生九死,不是说说而已。
Alnylam披露的这一组数据,与其他药物开发阶段转化成功率的研究也基本一致。2021年,全球规模最大的生物技术行业组织之一BIO、Informa Pharma Intelligence、QLS联合发布了一份关于药物临床开发成功率的报告。
该报告对2011年至2020年,Biomedtracker数据库中的1779个公司中,9704个药物的1.27万个临床开发项目进行分析后发现,1期临床到2期临床的成功率为52.0%,2期临床到3期临床的成功率最低为28.9%,3期临床到提交新药上市申请的成功率为57.8%,递交NDA/BLA到获得FDA批准阶段的成功率则为90.6%。
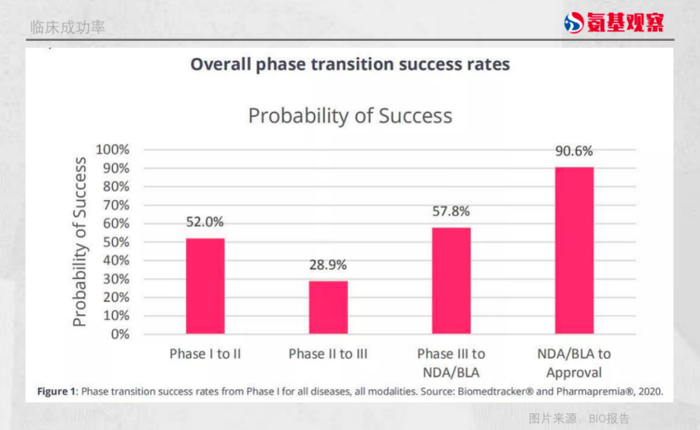
算下来,只有7.9%的新药能够从1期临床成功进展到最后的FDA批准上市阶段。
无论是7.9%,还是5.7%,对比下来,Alnylam的临床转化率均足够高。
另外,在研发费用方面,2013年至2023年,Alnylam在10年间累计投入了60.6亿美元。作为对比,Novavax和BioNTech过去10年的研发投入,与之最为接近,分别为63亿美元和58亿美元。
其中,BioNTech与Alnylam使命更为接近,同样是在一个未知、未被验证的领域进行探索,但其成立至今已获批上市的仅有mRNA新冠疫苗。
不过,BioNTech也是幸运的。靠新冠疫苗积累了巨额财富,在手现金高达169亿欧元,足够继续烧钱买买买和大开临床试验。
那么,Alnylam是怎么做到64.3%的极高临床转化率呢?
02 死磕技术
这还要从RNAi药物的机制说起。
1998年,来自美国的两位科学家将双链RNA导入线虫基因中,并发现双链RNA较单链RNA更能高效地特异性阻断相应基因的表达,他们称这种现象为RNA干扰(RNAi)。
RNAi药物通过提供专门设计的小干扰RNA(siRNA)来模拟这一过程,这些siRNA作为RISC(RNA诱导的沉默复合物)的一部分,与致病mRNA结合。一旦找到靶向mRNA,就像一把分子剪刀一样,siRNA与RISC一起切割“不需要的”基因,使其降解。
说得简单点,就是siRNA破坏了原本的基因表达过程,导致一些基因表达被阻断,自然也就没法继续发挥任何致病功能。
相比小分子和单抗,RNAi药物可以靶向沉默基因组中的任何基因,具有强力和持久的作用机制,可以解决致病蛋白“不可成药”的难题;而在药物合成方面可能比筛选小分子或者生成生物制剂更为简单,其只需要锁定致病基因序列,通过与mRNA 完成 Watson–Crick 碱基配对来实现其功能,无需契合蛋白质的复杂结构,因此研发成功率相对较高。
理论如此,但行业的发展不可能一帆风顺。RNAi曾一度面临着稳定性差、递送效率低、安全性差等问题,其中,最为致命的是递送问题,siRNA一旦送入体内,会被血液中的酶会迅速破坏,无法顺利递送至靶组织细胞发挥作用。
2003年成立以来,Alnylam就将超过80%的研发投入专注于siRNA的递送。采用了多管齐下的策略,包括偶联物、脂质纳米颗粒和生物材料等多种递送方式。
前后花费几年时间,评估几十种靶向一系列组织的外部来源的递送系统,但结果都令人失望。而后,Alnylam通过与Arbutus达成合作,获得了后者的脂质纳米颗粒技术(LNP)的授权许可协议,Alnylam使用该技术来传递其首个RNAi治疗药物patisiran。
直到2012年,Alnylam的“关键武器”GalNAc偶联获得成功。Alnylam深知开发技术是其核心壁垒,即使GalNAc成为了向肝脏递送寡核苷酸的主要技术,但公司不满足于仅仅解决siRNA的递送障碍,还不断对siRNA序列进行改造,催生了增强稳定化学技术(ESC)和随后出现的ESC+技术,通过不同的RNA修饰持续提升GalNac的靶向性以及药效。
可以说,对于技术的坚持与突破,是Alnylam取得一切临床转化的基础。如果没有Alnylam对于递送技术的突破,或许RNAi领域还要在蹉跎几年。
03 产品导向
在Alnylam努力解决递送问题的十年中,外界对RNAi领域的热度快速激增,而后又以同样快的速度快速蒸发。
2010年,罗氏、辉瑞、默沙东等大药企纷纷退出RNAi领域,RNAi疗法走入了“至暗时代”。Alnylam的股价也跌至了冰点,为了活下去,不得不大幅裁员。
在行业遭受重创时,Alnylam决定将重心从平台转移到管线,因为要恢复对RNAi信心的唯一方法,就是拿出无懈可击的人体临床数据。
2011年1月,Alnylam启动了“Alnylam5x15”的战略计划,即在在2015年底前将5个RNAi治疗药物推进到临床阶段。
尽管研发团队反对,因为当时公司仅有一个肝靶向项目正在开发中,且尚未拿到人体临床数据,但在时任CEO的坚持下,Alnylam仍是向外界抛出了这一口号。
2011年秋天,Alnylam研究的第一个重要结果出炉,在ALN-TTR01的一期临床中,患者50-03表现出明显的TTR沉默。这一结果首次证明了在人体中利用RNAi的能力,对于Alnylam来说,这是一个里程碑意义的时刻。同时这也预示着RNAi药物一系列显著临床转化成果的开始。
2015年末,Alnylam成功将8个项目推进临床研发。3年后,其研发的RNAi药物Onpattro获得FDA批准,用于治疗hATTR(遗传性转甲状腺素蛋白淀粉样变性神经病)。这也是全球首款RNAi药物。
截至目前,Alnylam已经有5款获批RNAi药物。
除了前文提到的其对于递送技术研发的坚持与突破,更重要的是,Alnylam的产品导向。
所谓产品导向,Alnylam曾在其财报中进行过解释。简单来说,Alnylam开发的重点是那些具有高度未满足需求、具有经遗传学验证的靶点、具有在1期临床研究中进行临床活动评估的早期生物标志物的临床指征,以及明确的药物开发、监管批准、患者获取和商业化途径。
事实上,目前Alnylam所有的获批项目都基于遗传学验证过的靶点。典型如PCSK9靶点。2003年,研究人员发现在PCSK9基因中出现的突变会导致PCSK9蛋白的表达升高,并且推动LDL-C水平的上升,导致家族性高胆固醇血症的发生。
PCSK9成为第三个被发现的与胆固醇代谢有关的基因。之后不久,另一个研究团队报告在少数人中存在自然发生的抑制PCSK9表达的基因突变。这些人具有非常低的LDL-C,并且心血管疾病发病率显著下降,没有显示出其它的不良作用。
除了经过人类遗传学验证,PCSK9靶点之所以吸引人,还在于PCSK9蛋白主要在肝脏表达,这让其成为一个在正确组织里的高度验证靶点。正对Alnylam的技术路线,其与诺华合作研发的长效降脂针Leqvio,通过基因沉默的方式,直接阻止肝脏产生PCSK9蛋白,以达到持久的治疗效果。2023年Leqvio全年销售额3.55亿美元,同比增长2.17倍。
更具确定性,加上RNAi机制所独有的高成功率,使得其临床转化率极高。至今这些关键特征仍然在Alnylam的开发中扮演着重要作用。
04 偶然还是必然
尽管Alnylam认为,5x15是其从平台公司向产品公司转型的基础。但本质上,RNAi药物研发正是平台技术转化的成果。
换句话说,RNAi药物呈现出平台化的特点。就像ADC、mRNA技术平台那样,经过验证后,能够源源不断孵化新的管线。这也是Alnylam临床转化率高的核心原因之一。
正如行业老二Arrowhead公司CEO所言,只做一款药物是在赌博,要运用RNAi平台优势,多做药物,争取突破。
这也就很好解释了,为什么大多数初创biotech都是3-5个在研项目,而不管Alnylam、IONIS还是Arrowhead,管线都可以铺满屏幕,几乎都是10个起步。
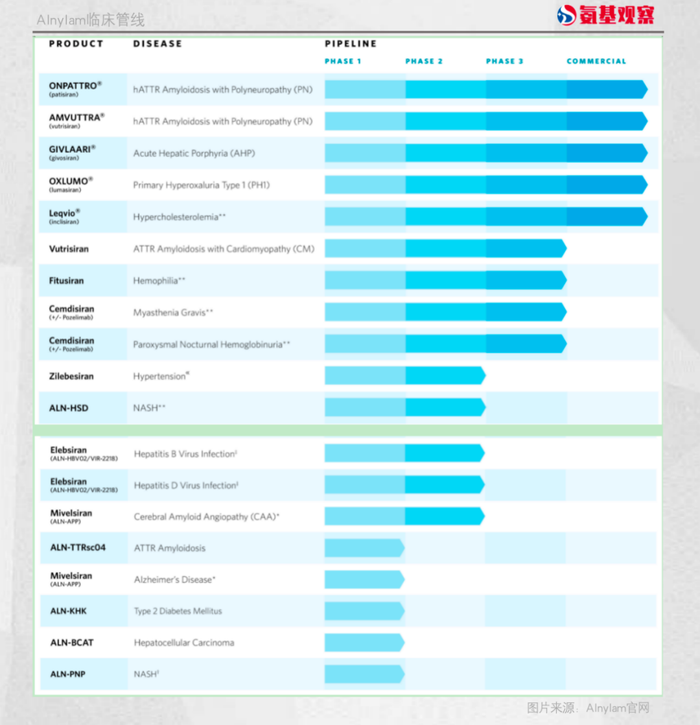
6月24日,Alnylam披露其RNAi疗法Amuvttra(vutrisiran)用于治疗ATTR-CM患者的Ⅲ期临床结果。在所有人群中,vutrisiran在主要终点和所有次要终点上均具有统计学显著性。其计划在年底前,使用优先审评券向FDA递交补充新药申请。
一旦成功扩围至ATTR-CM领域,意味着Alnylam将进入一片广阔的蓝海。数据显示,全球有20-30万人患有ATTR-CM,而获批的药物仅辉瑞的小分子稳定剂Tafamidis,去年销售额超过33亿美元。
更重要的是,公司可以该适应症获批带来的真金白银,继续源源不断地扩充管线,包括心血管疾病、神经性疾病、自免疾病甚至癌症等领域。凭借RNAi相对于小分子和抗体类药物的优势,包括疗效、给药间隔、安全性,再加上RNAi药物非常高的临床成功性,Alnylam将进入一个全新的局面。
Alnylam今日成就达成背后,有着不确定的偶然甚至运气,毕竟,RNAi机制是通用的,但其他RNAi玩家尚处于证明自己的阶段。但也总是偶然背后有必然。
对于Alnylam来说,这种必然既在于前文所讲的技术以及产品导向,也在于其对于一些质朴商业原则的坚持与实践。
比如对于人才的重视与尊重。创始团队包括诺贝尔生物医学奖获得者Phillip Sharp,生物物理化学家Paul Schimmel、分子生物学家David Bartel、生物化学家Thomas Tuschl和分子生物学家Phillip Zamore,这样的人才配置,对于一家技术型公司的意义不言而喻。
与此同时,Alnylam在公司层面非常重视科学家的自主创新,建立了“20%时间规则”,即使在公司运营成本逐渐增加的情况下,也要为研究团队提供一些自由度,鼓励科学家用20%的时间去实现自己的想法。
事实上,公司的几项重要突破,均是在这种鼓励创新的氛围下产生的。包括最为核心的GalNAc偶联技术,以及靶向中枢神经系统的C16偶联siRNA递送技术等。
很多人都创新当成了一个结果,但事实上,创新是一个过程。理解了这一点,你就会理解为什么一些企业难以激发创新活力。
除此之外,在2010年行业最低谷时,Alnylam仍决定坚持投入。最艰难的一次是在2016年,一项关键临床试验出现了问题,不得不停止研究。
消息公告后,Alnylam市值当天蒸发70亿美元,投资者担心更广泛的平台安全问题,波及整个产品管线,甚至整个RNAi领域。
这对Alnylam来说是非常大的考验,好在公司顶住了压力,这才有了2018年第一款RNAi药物的获批,以及RNAi疗法的实际验证。
无论是对人才的重视,鼓励创新的文化,还是在逆境中的坚守,这些原则对创新药企来说并不陌生,但真正能将之贯彻始终的,寥寥无几。这或许是Alnylam为行业带来的最大的启示之处。




评论