文|财健道 尹莉娜
编辑 | 昝立永
此前17天,信达生物(01801.HK)PD-1出海刚刚折戟,中国创新药企数据再度备受质疑。传奇生物此番闯关成功,表明FDA看重临床价值这一核心标准未曾改变。
2016年12月的冬天,纽约纽瓦克机场,47岁的范晓虎正在等待和一位驻加拿大的金斯瑞同事会合。二人此行,希望能在当地找到合作方,探索其CAR-T产品在国外开展临床试验的可能。
走出机场,一片白雪皑皑,范晓虎不禁在心底感慨:“我们能在这片一无所依的土地上,趟出路来吗?”
答案不得而知。
彼时的传奇生物,虽已注册成立公司,但几乎没什么家底,团队不足10人,实验室靠库房改建而来,设备则和金斯瑞公司其他部门共用。在美国这个市场,更是名不见经传。
“一没有足够资金,二没有足够多的人才,三没有成熟的技术”,甚至连公司官方网站都没有,范晓虎将当时的传奇称为“三无公司”。但这家“三无公司”,却有着一个国际化发展的“野心”,并由此开始了一场“豪赌”。
01 豪赌想走国际化战略的“三无公司”
上世纪九十年代,范晓虎在西安交通大学和日本广岛大学分别获得医学和应用免疫学博士学位,后赴加拿大完成了人类B细胞耐受领域的博士后工作,并从事器官移植临床工作,及B细胞应用免疫学方面的基础转化研究十多年。
期间,范晓虎在心脏移植的机制基础研究方面取得世界级重大突破,在《Nature Medicine》杂志上发表原著论文后,他有了从做基础科研到做新药的想法。
2014年,范晓虎回国加入了总部位于南京的金斯瑞生物,一开始主要负责抗体蛋白工程,大半年后,传奇生物注册成立,范晓虎作为技术研发负责人,带领团队开始专攻细胞治疗。
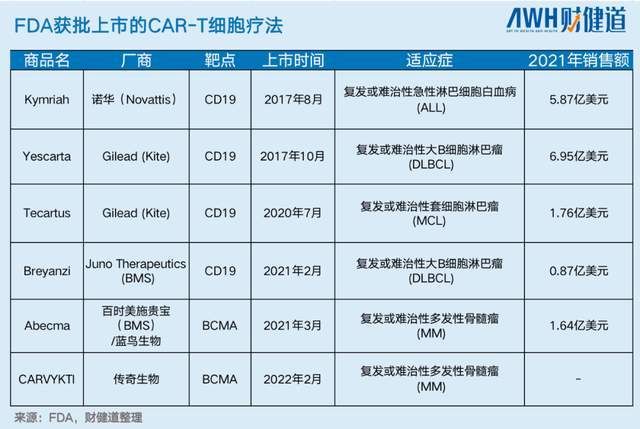
2010年之后,海外陆续出现CAR-T临床试验上的好消息。最为业内熟知的是诺华的Kymriah和吉利德/凯特公司的Yescarta,均是靶向CD19用于治疗B细胞淋巴瘤。
传奇的CAR-T产品,基于相同的作用原理,但适应症(多发性骨髓瘤)、靶点(BCMA)、结构设计和一些关键工艺均不相同。
基于个人十多年的海外临床和研究经验,范晓虎有了让Cilta-cel出海的想法:“这么好的产品,没有理由说到了外国人身上,就不起效了吧?”
如今回头看,一切都是从这个念头萌芽的,产生了“蝴蝶效应”般的变化。
“十亿美金,十年时间”的“双十定律”是业内对新药研发成本的概括,而在前沿技术领域,更有过之无不及。在2016年,传奇生物的母公司金斯瑞当年营收刚刚超过1亿美元,净利润则只有2600万美元左右。
出海的想法并未在第一时间获得支持。
任何战略决策,都不是一拍脑门决定的。为了拿出更有说服力的支撑理由,便有了范晓虎等人的美国之行。
那段时间里,两人把美国新泽西和附近几个州里能提供GMP级别的CMO公司跑了个遍,考察了各家供应商包括病毒载体、质粒及细胞生产等各个环节。
合作谈判的过程中,传奇需要做的内容和要求很多,但能支付的钱却很少。范晓虎说“我们没有钱,只能拼命把价格往下压。”
最终,一家提供学术性GMP生产服务的非盈利机构,在看完范晓虎手中的患者照片后,被打动了。
那是当时在国内由研究者发起的临床研究(IIT)入组的第六位病人,当时,患者已经被诊断为严重多发性骨髓瘤,全身已经出现许多病变包块,嘴里也坑坑洼洼布满口疮,浑身疼痛难以自理,15次化疗无果后,参加了传奇生物在西安交通大学附属第二医院的临床试验。
所谓“癌入骨髓”,不可治愈。但CAR-T的出现,有了突破这一医学瓶颈的希望。
输注CAR-T后20天左右,患者身上的包块开始有明显的消退趋势,几个月后,便彻底消失了。其体内的肿瘤也彻底被清除,恢复了正常人的无癌生活。
“肿瘤消失”,听起来仿佛天方夜谭,但这就是CAR-T的神奇之处。
我们每个人自身,都拥有一套强大的免疫系统,他们就像时刻在人体内“巡逻剿匪”的“免疫军团”,而存在于血液内的免疫T细胞,是整个军团的指挥官。当癌细胞在人体内大肆扩散时,其实是用特殊方法逃开了T细胞的监管,蒙蔽了指挥官的眼睛。
CAR-T疗法所做的,就是提取患者体内的T细胞,对其进行基因改造,让它重新识别癌细胞,再送回患者体内,患者就可以发动自有的免疫军团来消灭癌症。
此前,国内某知名肿瘤专科三甲医院专家曾告诉《财键道》:CAR-T属于“一锤子买卖”(一次性治疗),“成王败寇”,接受治疗的患者,5年生存率约40%。
不过,今天大热的基因与细胞疗法在当时还处于发展早期,甚至美国FDA对相关规范也尚不明确。此后的2017年,范晓虎找了许多相关专家,请教美国在细胞疗法临床试验的规章,并确定了临床CRO的机构,逐步着手推进在中美两国的IND(临床试验申报)。
此时的传奇生物,手里已经有了令范晓虎团队非常鼓舞的第一手数据。
02 认可“说真话的人”
范晓虎归国3年之后,CAR-T产品西达基奥仑赛(Cilta-cel)开始接受全球行业专家的一场大考。
2017年6月,传奇生物带着“35例复发或耐药患者,100%总缓解率”的临床试验数据,出现在ASCO(美国临床肿瘤学会年会)主会场上,当场就引起热烈反响。
对于多发性骨髓瘤这样的不治之症来说,100%总缓解率是什么概念?近年来治疗肿瘤技术成熟的“明星药”PD-1单抗,其应答率也仅在20%左右。
当年参会的另一家CAR-T公司蓝鸟生物(Bluebird),也是传奇生物在全球范围内唯一的竞争对手。蓝鸟的Abecma总缓解率为73%,完全缓解率为33%,与传奇生物Cilta-cel的差距是两位数水平。
经报道,传奇生物一夜走红,媒体将其与“中国黑马”划上等号。
业界对西达基奥仑赛(Cilta-cel)疗效震惊之余,还有对“中国数据”的怀疑。
曾经,由于历史遗留原因,中国临床数据存在造假泛滥的现象。2015年,原国家食药监总局发起了“722核查风暴”,引发了一场医药圈地震。当时申请上市的1622个药品中,有80%申请主动撤回。这场核查风暴,很大程度上扫除了数据造假的现象,也重塑了中国临床试验的真实性。
即使如此,2017年的ASCO会议上,对中国实验数据的可信度的疑虑仍然没有消除。
于是,台下的各大嗅觉敏锐的跨国药企(MNC),抱着将信将疑的态度,纷纷主动联系传奇生物。
范晓虎和团队刚刚走下ASCO大会演讲台,便在退场时被强生的高管围住,同时还有其他几家MNC,力邀范晓虎等人到其各自的公司访问。
这样的情况是范晓虎等人没料到的,整个团队当即便改签了回国的机票。
美国专家不问出处,只注重研究成果的做法,体现了其专业性和对科学的求真态度,范晓虎至今对此充满感慨:“如果不是这些专家当初的‘识货’和信任,我们还要走很多弯路。”
多家MNC中,强生对于双方合作表现得最为热忱。一个月后,其旗下的杨森公司便派出全球各地的十几位专家组团到中国开展尽职调查。得出的结论是——传奇生物是“说真话的人”,这项令全球惊艳的临床数据,没有造假。
从双方业务布局的契合度而言,杨森和传奇的携手几乎是注定的。
“虽然Cilta-cel的实验结果数据远优于竞品Abecma,但当时二者的研发进度不相上下,Abecma是蓝鸟生物从NCI(美国国家癌症研究所)引进,Cilta-cel是传奇自主研发,如果对手抢先上市,后续仅靠传奇是很难在美国与之抢占市场的。”范晓虎说。
因此,传奇生物想要打入美国市场,最佳选择是在血液肿瘤方面耕耘深厚的药企,在美国,这非新基和强生莫属。但前者早在2013年便与蓝鸟生物就CAR-T建立了合作。
基因与细胞疗法,是肿瘤治疗的明天。强生为了不落后于竞争对手,也一直在多方寻觅能够与蓝鸟产品匹敌的潜在药物。传奇生物的出现,让强生高层眼前一亮。
在后续的合作权益谈判上,双方耗时近半年时间。杨森开出了诚意十足的价格,但传奇生物想要的,不是高价出卖产品,也不愿意出让公司哪怕1%的股权。
传奇在谈判态度上的强势,或许更进一步传递出其对自身产品的底气,杨森主动提出,双方以五五分成的模式来分配上市后的产品收益。
最终,这项合作在2017年底尘埃落定,杨森支付传奇3.5亿美金首付款,以及后续多个里程碑款项,换取海外市场50%,大中华地区30%的收益,创下当时中国药企对外专利授权首付款最大金额与合作最优条件。
传奇生物CEO&CFO黄颖博士在产品上市时谈到,“这种合作方式整个周期很长,投入也非常大,所以我们在这个项目当中投入是跟杨森一模一样的,因为我们也是支出50%,这是财务上比较大的负担”。
“但是利用西达基奥仑赛这么一个过程去壮大传奇生物自己的能力,从我们的早期研发到后来晚期研发,从临床到商业化生产、GMP生产,以及合规注册,在这些所有流程中,传奇生物的团队都在积极共同参与。”黄颖博士这么评价道。
如果说ASCO大会的表现让传奇一炮而红,那么与杨森合作的达成,更让传奇“一战成名”。这些条款仿佛在说,一家名不见经传的初创公司,可以在百年制药巨头前坚持平等互惠合作。
截至2022年3月,传奇生物已经累计获得了合作伙伴的3.5亿美金的预付款和2.5亿美金的里程碑付款,合计6亿美金。
03 出海“第一个吃螃蟹的”本土CAR-T企业
在与杨森的合作落地前,范晓虎的心里始终绷着一根弦:“Cilta-cel的IND申报已经箭在弦上,万一杨森不愿意接受我们的条件,那传奇自己也必须硬着头皮做下去。”
从临床医生、科学家转身创业,范晓虎和团队此前并没有做药的经验,也没有申报CAR-T临床试验的经验,而中国CAR-T到美国申报,更是头一个。
“申报材料打印下来,需要我们自己逐字撰写。那一年里,我们整个团队几乎都没怎么休息,晚上经常要和美国方面开会沟通,白天工作,修改准备申报材料,一直在‘连轴转’。”范晓虎回忆道。
到了2017年年底,各类申报材料的准备逐渐进入尾声。杨森加入后,第二年(2018年)的3月和5月,Cilta-cel分别在中美两地获得了IND批件,几个月时间里同时在两地获批临床,这样的速度刷新了行业记录。
进入临床后,最关键的是1b/II期试验。
传奇生物的这项实验(CARTITUDE-1)在美国的16个中心和日本的4个中心开展,97例患者接受了CAR-T输注。试验最终结果,客观缓解率、完全缓解率、无进展生存期分别为98%、83%和3.3年。
对比蓝鸟产品,其相应数据为73%、28%和8.8个月。
后来的故事,则人尽皆知。
2022年2月28日(当地时间),基于上述研究,FDA正式批准Cilta-cel上市,第一款国产CAR-T成功出海。
产品获批之日,范晓虎内心很平静。“我的任务是研发,产品上市后就到了商业化阶段,接力棒就要交给其他人了。”
对于范晓虎来说,Cilta-cel上市是意料之中。他和公司研发团队,已经把精力转移到了下一代技术和产品的开发上,包括CAR-T对实体肿瘤如肝癌等的攻关,以及现货型/通用型产品的研发。
不过,出乎意料的是,美国市场对这款中国CAR-T的关注,超出了预期。产品获批当天,传奇生物尚未公开向外宣布,已有美媒率先“代劳”,甚至公布了Cilta-cel的定价——46.5万美元,略高于同类竞品蓝鸟生物的41.95万美元,在目前所有CAR-T中仅次于诺华。
西达基奥仑赛(Cilta-cel)上市新闻发布会上,作为传奇生物CEO的黄颖博士确认了这一价格:“第一,同类已上市产品的定价,均在40万—47万美元区间,我们46.5万美元是在美国上市CAR-T产品价格区间内;第二,作为第二个以BCMA为靶点的CAR-T,基于对疗效的评估,我们比同类竞争产品有溢价,溢价大概为11%。”
前述知名肿瘤医院专家表示,一次性的CAR-T如果价格过低,难以收回成本,双抗虽然单价便宜,但需要持续终生用药,所以听起来定价较高的CAR-T实际上属于合理价格范畴。
从申报、定价到商业化落地等,作为“第一个吃螃蟹的”本土CAR-T企业,国内同行都在注视着传奇生物。而这其中,商业化成为传奇当前最大的挑战。
传奇的做法是,自建小而精的商业化团队,主要开发大型医院和诊疗中心(类似中国的三甲医院),目标覆盖美国此类医疗机构的75—80%。而合作伙伴强生,则主要专注拓展社区市场,面向美国约5500名血液肿瘤科专科医生推介产品。
在中国市场方面,黄颖博士透露,正在积极和国家药监局审评中心(CDE)保持密切沟通,积极做好相应的准备,期待未来早日能够让国内的多发性骨髓瘤患者获益。
04 中国创新药产业启示
十多年前,中国医药界对免疫疗法知之尚浅,最早的数家PD-1企业也才刚刚成立。
彼时的范晓虎曾回国做访问教授,提出与国内学界做免疫治疗研究,却被认为太过“激进”“虚无缥缈”,其本人也被调侃为“象牙塔里的学者”。
但短短几年后,范晓虎再次回国时,却有了留下来潜心研究CAR-T技术的环境。
此前在国外做肾脏移植的临床医生时,如何解决免疫细胞的排斥,是范晓虎主要攻关的问题,而到了CAR-T领域,则是如何改造利用免疫细胞,虽然作用机制相反,但其中曲径相通。
从对付免疫细胞,到改造利用免疫细胞,关键领域的创新突破来自数十年间的积累,因此当它迸发之际才显得那样波澜不惊。
肿瘤与免疫时代的上半场,无论在PD-1单抗或“替尼类”小分子药方面,中国创新药产业一直在积累与追赶,无论仿创也好,快速跟随也罢,都是不可跳过的必经之路。
进入基因与细胞治疗为主角的下半场,以传奇生物的CAR-T产品为代表,已经出现了全球最优的Best-in-class新药,行而不辍则未来可期。
(作者系《财经》研究员)
制图 | 李紫雅
参考文献
【1】传奇生物CAR-T通过FDA审评背后:一场充满冒险的成功,深蓝观,郑洁,2022.02【2】拿下高瓴32亿投资的它又赚了1个亿,这个赛道赚钱效应显现?创业邦,高嵩,2021.05



评论