文|财健道 杨燕
编辑|杨中旭
跟现在二价HPV疫苗欢天喜地的获批相比,还在“襁褓”中的国产HPV九价疫苗将在五六年后,“出生即内卷”。
“怀胎”11年,国产HPV疫苗“老二”终于获批上市。
3月24日,国家药监局官网显示,沃森生物(300142.SZ)全资子公司旗下重组HPV二价疫苗正式获批上市,目前中国大陆市场获批使用的HPV疫苗增至5款。

二价已经来了,国产九价还会远吗?
和大部分人预想不同的是,一位专注于疫苗企业投资与并购的行业人士告诉《财健道》,已经有二价HPV疫苗上市的企业在九价的上市过程中可能快人一步,但距国产HPV九价疫苗真正大规模上市仍然需要5-6年的时间。
该人士指出,鉴于世卫组织(WHO)提出了2030消除宫颈癌规划,等HPV九价国产疫苗2027-2028年上市时,大部分潜在用户应该都已经完成二价的接种了。
到那时,国产九价的主要市场,将是新生儿。问题是,出生率处在断崖下跌的通道中。
让我们大胆猜测,等国产九价上市后,会从现在的“又贵又难约”变成廉价药,药企赔着本儿赚吆喝。
01 HPV九价疫苗上市背后,审批标准卡住了时间窗口
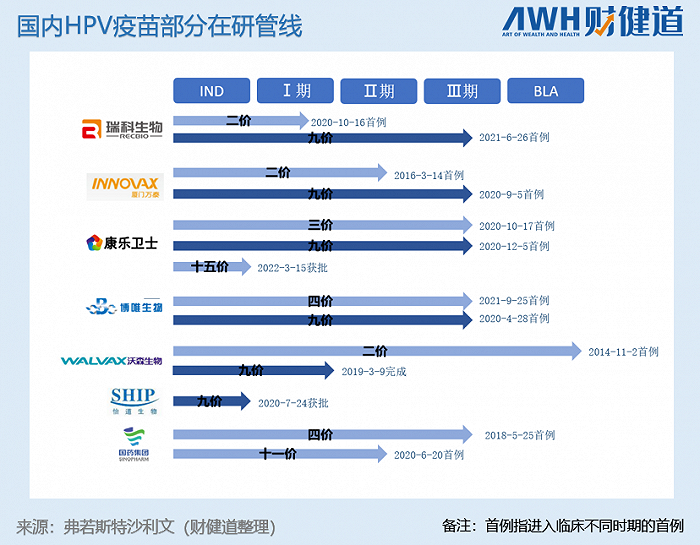
国内HPV在研产品管线丰富,但若无意外,国产九价疫苗第一股的“王座”候选人只在万泰生物(603392.SH)和沃森生物(300142.SZ)之间。
从临床到上市,万泰生物的二价HPV疫苗走了近18年,沃森也花了快11年的时间。这为他们的九价疫苗赢得了远超国内同行的先发杆位。
一款疫苗的上市之后,对相关群体产生的影响往往长达5-10年的时间,因此疫苗产品的审批历来较为复杂。
HPV疫苗一直以来就有两种标准之争。最早阶段,WHO制定的标准是以宫颈上皮癌前病变(CRN)2级及以上作为临床试验终点指标,后来欧美、日本、印度等国则以抑制HPV持续病毒感染率作为临床终点指标。
2012年,葛兰素史克(GSK)二价疫苗准备在中国上市时,遇到的“关卡”就是因为两种审批的博弈。直到2016年,GSK延长了研究周期,才获批登录中国市场。对这段行业往事感兴趣的欢迎在后台回复“HPV”,来聊聊宫颈癌疫苗的10年上市路。https://xueqiu.com/8965749698/72209960
2016年,WHO已经对HPV疫苗的有效性评价标准做出更改,以病毒持续感染的数据取代癌变的数据作为终点指标。
而CDE现行指导原则规定,若有以病变为终点上市的产品,其后续产品可以采用持续感染为终点,对于没有产品上市的疫苗产品,则必须以病变作为临床终点。
两种标准背后,是临床试验的时间长短之分。HPV从感染到出现癌前病变,平均要5年,最长10年,这也意味着疫苗上市前临床试验至少需要5年;但如果以HPV持续病毒感染率作为临床终点指标,一般仅需12个月持续感染。
也就是说,目前还没有二价HPV疫苗获批上市的其他厂家,必须以病变为终点进行临床试验,而万泰生物和沃森因为已经有产品上市,他们的高价疫苗就可以以抑制HPV持续病毒感染为临床试验终点。后者比前者,省去了4年临床时间。
万泰生物在近期的投资者调研纪要中表示,公司符合CDE提到的“有产品上市,后续产品采用持续感染为重点”这一情况,但最终还要取决于国家药监局的审批。
前述行业人士做出的时间预测依据正是来自于HPV疫苗背后的审批标准,在他看来,国内报产最快也得1.5-2年,也就是说,尽管万泰生物和沃森生物因为有二价产品上市而节约了临床时间,也不可能很快就上市。
华西证券在近日的研报中提到,万泰生物九价HPV疫苗大概率将以持续感染作为临床终点进行申报上市,很有可能在2024年底或2025年初获批上市,成为首个国产九价HPV疫苗产品。
不过,在2021年9月在公众平台跟投资者互动时,万泰生物对于III期临床方案给出的时间规划表是66-78个月,也就是5.5-6.5年。按照其2020年9月5日III期首例入组来看,万泰生物的九价应该还有3-4年的时间才会进入报产阶段。

02 世卫规划在前,留给国产九价的市场不多了
近一年来,HPV疫苗的热度始终居高不下。
无论是各地免费为适龄女性接种HPV疫苗,还是瑞科生物赴港上市,康乐卫士冲刺北交所,背后产业和资本显然都为这一尚未开发完全的千亿市场鼓足了劲。
万泰生物最新财报显示,公司2021年实现营收57.5亿元,其中疫苗板块实现营收33.6亿元,贡献了超过六成收入,毛利率更是高达92.55%。
不容忽视的是,国内HPV疫苗市场长期以来一直被默沙东和GSK两家公司所掌控,直到2020年万泰生物二价HPV疫苗上市,国产替代步伐才开始加快。国金证券研报显示,2021年万泰生物二价HPV疫苗签发批次达到65%,而GSK的二价HPV疫苗批签发批次占比仅达到5%。
性价比和政府主导免费接种这两大因素正将国产HPV疫苗推向市场C位。
据《财健道》不完全统计,目前市场上涉及HPV疫苗研发的机构超过15家,其中不乏研发高价HPV疫苗的厂家。他们能赶上这波市场扩容期带来的红利吗?
前述行业人士对于国产九价疫苗的未来增长显得并不乐观。
他给《财健道》算了一笔账,从目前各家进度来看,国产九价疫苗大部分都要2027-2028年才能出来,那时候国内市场是个什么情况呢?
从WHO2030消除宫颈癌规划这个大前提来看,中国在2030年对于HPV疫苗的接种,甚至宫颈癌的早筛早检都应该已经落地,大部分女性未来必然都会接种二价/四价。国产九价疫苗上市时,用户只剩下两种,已经打过二价/四价的想要再升级,但主要市场还是每年的新生人口。
国家统计局数据显示,2021年中国出生人口约为1062万,较2020年1200万出生人口减少约138万,下降11.5%。从下图可以看出,未来人口增长趋势明显向下。
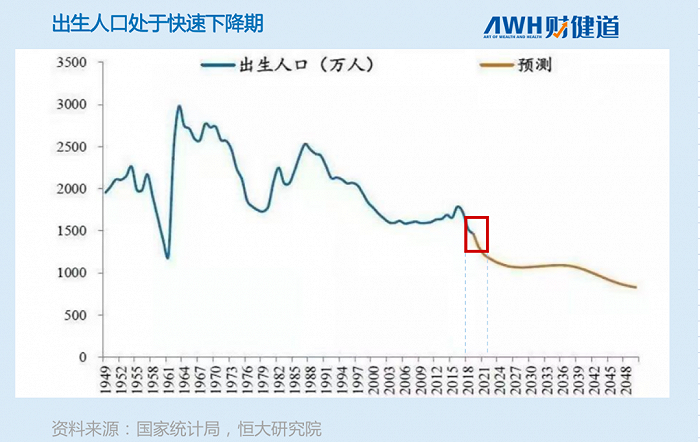
从近些年来的人口出生率看,九价疫苗的增长空间跟当下完全没法比,市场太拥挤了。换言之,未来针对男性用户的HPV疫苗有可能成为黑马,因为针对的是新用户群体。
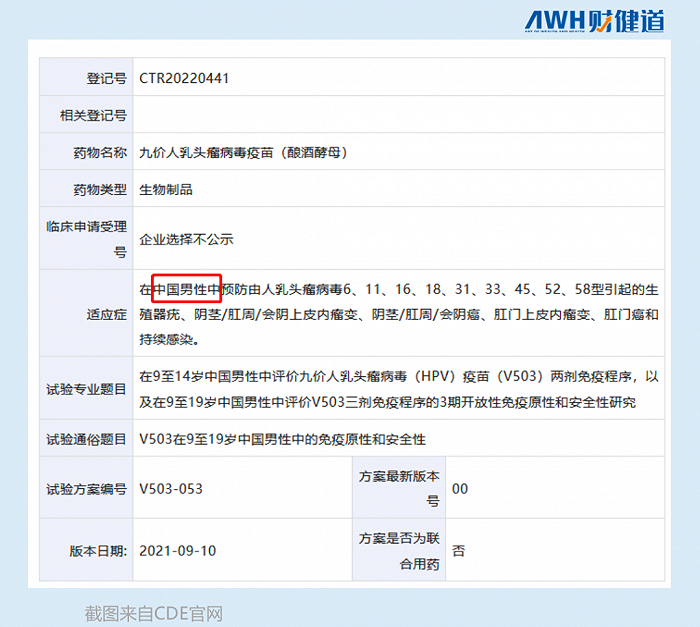
默沙东去年9月就提交了针对男性用户的九价HPV疫苗大规模临床试验申请,康乐卫士针对男性的九价疫苗,也进入了Ⅰ期临床阶段。
除了早早布局男性用户之外,更多的HPV疫苗厂家将目光放在了全球市场,尤其是泰国、尼泊尔、菲律宾、埃及、墨西哥及若干个Gavi(全球疫苗免疫联盟)国家。
未来关于国产HPV疫苗企业的赛场不只在中国,还应跟创新药一样关注全球市场。



评论