文|动脉新医药
TIL领域,最近很是热闹。
在融资方面,卡替医疗、君赛生物、蓝马医疗3家TILs疗法研发公司接连官宣完成新一轮亿元级融资。涉及融资总金额3.8亿元,平均每笔融资1.3亿元。
在临床进展方面,沙砾生物TILs疗法GT101的临床试验申请以及君赛生物的TILs疗法自体天然肿瘤浸润淋巴细胞注射液的临床试验申请陆续获NMPA受理。2月10日,劲风生物再传喜讯——宣布其TILs疗法产品获得美国FDA批准进入临床一期。劲风生物成为国内首家TILs疗法产品获批进入临床的TILs疗法研发企业。

放眼全行业,“Iovance Biotherapeutics公司TILs疗法产品Lifileucel预计在2022年获批”的呼声不断,TIL领域有望在今年迎来首款获批产品。
对于TIL领域来讲,2022年注定是不平凡的一年。

基于国内TILs疗法领域发生的诸多新进展,动脉网近期对国内TIL领域进行了全盘梳理,推出了两篇行业内容。在上一篇《即将诞生首个实体瘤细胞治疗产品,这个赛道会是今年的大热产品吗?》文章中,我们主要从国内TIL领域近期热点入手,梳理了全球TILs疗法发展的关键历史节点、详细介绍了TILs疗法相较于其他免疫细胞疗法的4点具体优势,并对全球TILs疗法上市企业以及行业TILs疗法最新临床进展做了详细披露,最后展露了国内8家TILs疗法企业的产品管线最新发展情况。
本文将接续上篇文章的逻辑,对国内8家TIL企业的发展现状(基本情况、技术平台特色、在研管线最新进展以及融资情况)加以详细介绍。国内8家初创企业争雄,谁将会是TIL领域最闪亮的“黑马”?甚至与当今TIL领域的全球头部企业lovance争辉?扎根国内本土的TILs疗法企业相比在国外发展又具有哪些优势?
01 14起融资涉及融资总金额22亿元,平均单笔融资金额1.5亿
自2020年2月发生第一笔融资事件,2020年至今TIL领域共发生16笔融资事件,公开透露的14笔融资事件涉及融资总金额高达22亿元,平均每笔融资金额为1.5亿元。

国内TILs赛道融资情况一览
截至目前,2021年TIL赛道融资事件总数最多,包括9起,公开透露的7笔融资事件涉及融资总金额高达15.4亿元,平均每笔融资金额为2.2亿元。2020年融资TIL赛道融资事件为4起,涉及融资总金额高达2.8亿元,平均每笔融资金额为0.7亿元。
02 8家初创企业争雄,谁将成为TILs领域最闪亮的“黑马”?
在8家TILs疗法企业中,谁最受资本青睐?每家企业发展现况如何?以下我们将对各家企业基本情况、技术平台特色、在研管线最新进展以及融资情况加以详细介绍。
西比曼生物:从二级市场转身的“大哥”,拥有世界级细胞治疗CMC工艺,2条TILs管线在研

西比曼生物成立于2009年,是首个在美国纳斯达克挂牌上市的中国细胞治疗生物科技公司。2021年2月20日,西比曼生物宣布完成由云锋基金、泰福资本、CEO刘必佐主导的买方团发起的私有化交易。2021年9月,西比曼生物完成1.2亿美元A轮融资。 TILs疗法只是西比曼生物的业务之一。据官网信息,西比曼生物拥有两个主要的细胞技术平台:(1)免疫细胞疗法平台;(2)干细胞平台。2018年10月,西比曼生物从美国国家癌症研究中心(NCI)引进 TILs疗法相关专利技术,用于开发、制造和商业化下一代新抗原反应性肿瘤浸润淋巴细胞(TIL)技术,以治疗包括实体瘤在内的更多类型的癌症。 目前,该公司主要开展了2条TILs疗法产品管线:TIL1 (Combo w/ Anti-PD-1)目前处于临床前研究阶段,临床适应症为非小细胞肺癌;TIL2(Combo w/ Anti-PD-1)目前处于概念验证阶段,临床适应症为其他实体瘤种(胃癌、宫颈癌、头颈癌等)。
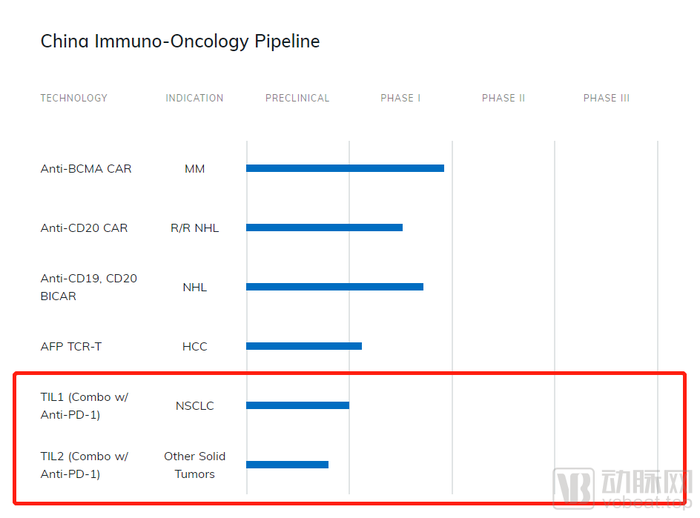

西比曼生物拥有世界级的细胞治疗CMC工艺。2018年9月,西比曼生物与诺华公司达成战略许可和合作协议,负责在中国生产和供应CAR-T细胞疗法KymriahR(tisagenlecleucel)。KymriahR于2017年8月被美国FDA批准上市,是全球首个获得美国FDA上市的细胞治疗产品。当前,KymriahR已在美、加、欧、澳、日上市,用于治疗白血病和淋巴癌。KymriahR产品的生产、质控相关技术、工艺、体系也全面落地西比曼生物。
卡替医疗:无需依赖手术取材,“超强型TIL”也能实现强效抑癌效果
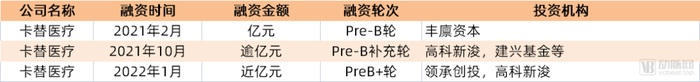
卡替(Chineo)医疗成立于2015年,是中国TIL/新抗原/创新CAR-T等创新免疫细胞治疗的代表性企业。截至目前,卡替医疗总计获得近5亿元融资。 卡替医疗自主研发的“超强型TIL”免疫细胞治疗技术借助“增强受体”和“扩增因子”等专利技术,通过对TIL细胞进行基因改造,使得TILs获得了攻克肿瘤微环境障碍的能力,以及在体内近乎无限复制扩增的能力的功能超级增强后的细胞,并凭借TILs对肿瘤的天然的特异识别性,从而同时解决肿瘤识别、克服微环境和高效扩增的三大难题,实现强效抑癌效果。

超强TIL的制备流程(图源:卡替医疗官网)
ScTIL是卡替医疗在传统TIL疗法基础上开发的第四代TIL,该款产品细胞来源无需依赖手术组织,而仅需外周血采集——从而大大提升了治疗实施的便捷性,并进一步给予基因修饰,使得TIL获得了攻克肿瘤微环境障碍的能力,以及在体内扩增的能力的功能增强后的细胞,并凭借TIL对肿瘤的天然的特异识别性,从而同时解决肿瘤识别、克服微环境和高效扩增的三大难题,实现强效抑癌效果。在前期的概念验证临床研究中,该产品取得了积极的疗效和安全性。
原启生物:自主搭建Ori TIL细胞高效扩增稳定可控培养平台,有效解决TILs多项瓶颈问题,3条TILs管线在研
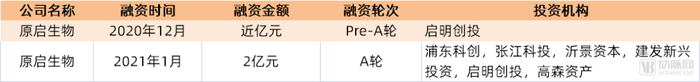
原启生物(原名“原能医学”)成立于2015年,专注于肿瘤免疫新药的研发。同西比曼生物一样,原启生物的产品管线不限于TILs疗法,还开发了包括CAR-T、UCAR-T、单/双特异性抗体等聚焦于肝癌、卵巢癌、胃癌、宫颈癌、非小细胞肺癌的多款产品管线。截至目前,原启生物总计获得近3亿元融资。 在TILs领域,原启生物构建了Ori TIL细胞高效扩增稳定可控培养平台。该平台拥有三大技术手段有效解决TILs体外扩增难度大,无特异性肿瘤残留检测方法以及制备成本高昂等瓶颈问题:
(1)提升年轻态TILs细胞增强肿瘤杀伤活性和纯度,增强组织驻留记忆性T细胞(TRM)同时缩短细胞培养周期,保障了临床应用的有效性;(2)开发了通用新型的检测方法,低于普通检测下限,T细胞成分明确,质量可控,确保回输制剂的安全性;(3)应用封闭体系生产,从培养基、因子等试剂耗材以及设备、人员、场地等方面降低了平均制备成本,提高了临床治疗成本的可负担性。

据官网信息,目前原启生物布局了3条TIL产品管线:OriTIL-001(适应症为骨肉瘤)、OriTIL-002(适应症为宫颈癌)、OriTIL-003(适应症为非小细胞肺癌)。其中,OriTIL-001和OriTIL-002目前已通过医院伦理审核,启动了探索性临床研究。 2021年中国临床肿瘤学会(CSCO)年会上,原启生物首次公开治疗肺转移骨肉瘤的临床研究进展。初步临床数据显示,OriTIL-001在治疗复发难治型骨肉瘤中表现出良好的安全性。
君赛生物:TILs疗法自体天然肿瘤浸润淋巴细胞注射液的临床试验申请已获NMPA受理

君赛生物成立于2019年7月,专注开发基于TILs的实体瘤创新疗法与"first-in-class/best-in-class"细胞疗法,覆盖多种复发难治性肿瘤。截至目前,君赛生物共计完成3轮融资,融资总金额为2.7亿元。
公司创始人&CEO&CTO金华君博士,具有丰富的产学研医跨界背景,在肿瘤免疫机制研究和细胞疗法领域深耕十多年,积累了大量的第一手研发与临床研究经验,通晓实体瘤细胞治疗的痛点、改进方向与改进策略,熟练掌握细胞新药早期设计、工艺与检测技术开发、临床前研究、临床研究、新药注册申报等全流程,全球首个自表达抗体的CAR-T细胞治疗实体瘤的临床级技术,以及国内首个基于非病毒载体的CAR-T细胞新药品种,自主建立高效简便的TIL细胞富集培养技术以及转基因TIL细胞治疗方案。
目前,君赛生物现已建立TIL细胞富集培养和高效安全的非病毒载体T细胞基因修饰等核心技术。2022年2月9日,CDE官网显示,上海君赛生物科技有限公司的TILs疗法自体天然肿瘤浸润淋巴细胞注射液的临床试验申请获NMPA受理。

蓝马医疗:从科研到产业,创始人团队在TILs疗法领域已深耕近20年

蓝马医疗成立于2020年12月,专注于开发以TILs疗法为核心的细胞免疫治疗产品。蓝马的主要研发方向为基因改造TILs细胞以提高TILs治疗疗效,TILs治疗联合其他免疫治疗、靶向治疗或放化疗的综合治疗模式,以及开发新型基因载体运输特异性T细胞至肿瘤等。截至目前,蓝马医疗共计完成2笔融资,融资金额近1.5亿元。
蓝马医疗创始人团队在TILs领域深耕多年,其中两位在MD安德森癌症研究中心TIL试验室具有长期研究的工作经历,主要从事TILs疗法的产品开发及工艺优化。同时,创始人团队具有丰富的TILs治疗产业经验,曾在美国最大TILs疗法公司负责开发相关产品管线,并参与完成了相应产品在美国FDA的申报。从科研界到产业界,创始人团队在TILs疗法领域积累了近20年产品生产、优化及团队管理经验。
在对外合作方面,蓝马跟国内外顶尖的医疗中心与医疗专家都建立了紧密的合作关系:紧密的国际科研交流与国内丰富的临床专家和患者资源将助力蓝马快速推进产品研发进展。
目前,蓝马医疗已经完成了核心工艺流程的研发和建立,以及部分进口原材料及试剂的进口替代。据蓝马联合创始人兼CSO Feng li 博士介绍,蓝马医疗产品LM103注射液(TILs)采用最新开发工艺,无论细胞数量(>1X1010)和细胞活度(>90%)、扩增速度较同类型产品具有较明显的优势。
另外,蓝马医疗苏州GMP厂房目前已经完成验收,计划2022年将自主创新药(LM103注射液,TILs)用于参加研究的恶性肿瘤患者。
劲风生物:国内首家TILs疗法产品获批进入临床的TILs疗法研发企业

劲风生物由科学家型企业家于福利博士在2020年发起创立,旨在通过将多组学/生物信息学/人工智能与细胞疗法进行无缝整合,提高TILs的有效性,发展TILs疗法在临床上的应用。截至目前,劲风生物共计完成2轮融资,融资金额近1.3亿元。
基于基因组学和蛋白质组学,劲风生物突破了肿瘤液态活检及单细胞测序技术上的瓶颈,通过结合无创肿瘤检测筛查在精准细胞治疗领域的研发及应用、利用生物信息技术及人工智能技术深度挖掘肿瘤多组学数据,以期智能优化细胞治疗策略,提高肿瘤治疗有效性,提升患者生命质量。
据悉,劲风生物还未成立前,就得到了行业领域的知名专家认可——美国科学院院士,贝勒医学院遗传系系主任Brendan Lee 教授基于对于福利博士的认可,在劲风生物筹划之初就成为其天使投资人,目前还担任公司SAB专家。SAB还包括美国医学院院士, 全球细胞治疗领域领袖Helen Heslop教授,她领导过20几个细胞治疗注册临床试验。
成立至今,劲风生物充分发挥团队创新能力,一直打磨开发其尖端的TIL(肿瘤浸润淋巴细胞)治疗平台,目前其“武器库”包括新抗原驱动TIL、单细胞多组学TIL子克隆扫描 (neoTCRTM),以及端到端CMC (NextGenTILTM)。
2022年2月10日,劲风生物宣布其TILs疗法产品已获得美国FDA批准进入临床一期,接下来将同美国一流癌症治疗中心和顶尖临床PI共同合作推进该产品的临床研发,2022年劲风生物预期达到在中美申报特色实体肿瘤适应症的里程碑。
作为Biotech公司,成立一年多就将产品推入临床阶段,这在中美都是飞速。作为国内首家TILs疗法产品获批进入临床的TILs疗法研发企业,由于福利博士带头的管理团队展现出了在技术研发和商业操作方面并重的执行力,以及中美互补的优势。2021年劲风生物已经开始GMP车间(占地几千平米)的建设,预计在2022年底落成并投入使用。
沙砾生物:TILs疗法GT101的临床试验申请已获NMPA受理

Grit Biotechnology(沙砾生物)成立于2019年,专注于针对实体瘤的肿瘤浸润淋巴细胞(TIL)创新产品的研发及临床应用。截至目前,沙砾生物共计完成2笔融资,公开透露A轮融资金额为1亿元。 沙砾生物核心团队在肿瘤免疫领域深耕多年,科学背景高度互补,其中70%都具有海外的细胞治疗工业化经验。在对外合作方面,沙砾生物目前已与国内10多家顶级医院组成战略合作伙伴,取得了大量的临床样本以支持工艺开发。
目前,沙砾生物已经建立了三个技术平台作为其TILs产品开发的基石:(1)StaViralTM——稳定病毒生产细胞系——一种高效的 T 细胞编辑平台;(2)ImmuT FinderTM——免疫调节靶点查找器——一个识别 T 细胞优化的发现平台;(3)StemTexpTM——Stemness TIL 扩增技术 ——一种专有的扩增方法,使TILs成为一种可行的细胞治疗产品。

沙砾生物目前有多条TIL产品管线在研,探索的目标适应症包括黑色素瘤、宫颈癌、肺癌、消化道肿瘤、妇科肿瘤等。2022年1月30日,沙砾生物TILs疗法GT101的临床试验申请获得NMPA受理。

循生医学:TILs产品AVL-201目前处于IIT探索阶段,适应症为妇科及其它实体瘤
循生医学成立于2021年3月,致力于开发新型个体化肿瘤免疫治疗产品,目前该公司主要搭建了两大核心技术平台:(1)针对实体瘤开发的TILs治疗平台;(2)针对宫颈癌(HPV)开发的核酸疫苗治疗平台。 据了解,循生医学核心高管团队来自世界500强国际制药公司。该公司依托于强大的新药应用转化科学家资源,与来自全球的基础研究及临床医学研究领域的科学家合作,共同完成从实验室创新到临床应用的转化研究。
通过多年的研究积累,循生医学团队能够将从患者体内取材得到的TILs进行“激活”,在恢复TILs抗肿瘤活性的同时提高TILs对于肿瘤细胞的“打击”能力,加强TILs对患者体内肿瘤细胞的杀伤作用。为保证TILs产品的疗效以及安全性,自研发始,循生医学就严格按照细胞药物的相关申报标准进行了新药申请。
目前,循生医学已经与解放军总医院肿瘤中心达成合作,完成了TILs细胞治疗产品的基础研究和临床前开发。据循生医学联合创始人&董事长刘洪川透露,公司开发的TILs产品AVL-201的研究目前处于IIT探索阶段,适应症为妇科及其它实体瘤。
总的来讲,企业在资本市场的欢迎程度往往与企业团队能力成正比,但不代表企业的绝对能力。企业的实力如何最终还是要靠产品说话。由于以上各家TILs疗法企业所开展的业务存在偏差,因此各家企业融资金额的高低并不代表企业在TILs疗法领域的话语权。
03 国内TILs产业发展已经进入快车道,本土发展环境具有诸多优势
目前,劲风生物的TILs疗法产品已获FDA批准进入临床1期,沙砾生物TILs疗法GT101的临床试验申请及君赛生物的TILs疗法自体天然肿瘤浸润淋巴细胞注射液的临床试验申请也陆续获NMPA受理。这说明我国的TILs疗法产业已经步入新台阶。随着越来越多的海外精英人才归国,该领域必将有更多的种子选手诞生。
照产业目前发展的形势来看,中国在TIL产业的发展与国外相比差距并不很大,部分TILs疗法团队认为,就TIL企业发展的环境来看,其实国内企业拥有诸多方面的发展优势。主要表现在:
(1)国内人口基数大,患者资源更加丰富;
(2)国内高发肿瘤种类与国外不同,部分癌种在表现症状上也与国外有较大差异;这为国内TILs疗法企业探究产品的更多适应症提供了更大的创新空间和市场;
(3)国内顶级三甲医院能力不输国外医院,甚至综合业务能力更强,效率更高。对于需要对病人进行组织取材的细胞疗法来讲,无疑提供了莫大的方便;
(4)无论是人力成本还是各类物资成本都比国外更低;
(5)当前国内政策环境良好,政府园区配套服务全面且灵活;资本对优秀的新兴技术企业拥抱度高。
除去以上优势,我们也不能忽略当前国内TILs疗法面临的客观困难。
掣肘国内TILs疗法发展的关键瓶颈仍然包括TIL的富集与扩增,肿瘤微环境抑制,手术取材难,细胞制备周期长/成本高等问题。另外,在基础研究方面,相比已经发展TILs疗法30余年的美国,中国在TILs疗法方面的研究深度与广度还不够;在政策监管方面,我国对于TILs疗法仍然没有建立较为完善的制度标准。但这些问题,都随着时间会被慢慢解决,无论是科研界,产业界还是政府,都在齐心协力共同推进先进疗法的发展应用,这是百万肿瘤患者的翘首以待。
目前,随着国外一些在TILs疗法领域深耕多年的资深优秀科学家、产业人士的陆续回国,我国在TILs发展领域已经进入了快车道。TILs疗法的未来,既清晰又明朗。如果Iovance 的TILs疗法产品Lifileucel能在今年顺利上市,国内对于TILs疗法的热情必将更上一个台阶。
2022年,对于TIL来讲,必不平凡。




评论