文|青眼
5月20日,国家药监局发布公开征求《关于医用透明质酸钠产品管理类别的公告》(修订草案征求意见稿)(下称“意见稿”)和修订意见。其中明确了医用透明质酸钠作为医用敷料应用时,若产品不可被人体吸收且用于非慢性创面,按照第二类医疗器械管理。由此,不少行业人士认为,这是给二类透明质酸钠敷料“松绑”了。
最低二类,医用透明质酸钠敷料开放
2009年原国家食品药品监督管理局发布《关于医用透明质酸钠产品管理类别的公告》(2009年第81号,以下简称81号公告),其中仅根据不同临床用途(适应症),将医用透明质酸钠产品按照了2种情形进行管理。

81号公告距今已有13年,这期间各类新产品不断涌现,81号公告已不能完全满足行业发展和监管需要。因此,此次意见稿正是对81号公告的修订、补充。
据悉,此次意见稿根据不同预期用途(适应症)、工作原理等,将医用透明质酸钠产品分为了“按照药品管理”“按照不低于第二类医疗器械管理”“按药械组合管理”3大类别,共计16种情形。这就意味着医用透明质酸产品最低的合规门槛为第二类医疗器械。


其中,在“按不低于第二类医疗器械管理”中,共包含了11种情形。值得关注的是,意见稿明确指出,医用透明质酸钠作为医用敷料应用时,若产品可部分或者全部被人体吸收,或者用于慢性创面,按照第三类医疗器械管理;若产品不可被人体吸收且用于非慢性创面,按照第二类医疗器械管理。

据青眼调查了解,虽然早已有二类透明质酸钠敷料获批,但仅是少数省份。因此,在不少业内人士看来,此次意见稿释放出“国家对二类透明质酸钠敷料产品松绑”的信号。
值得一提的是,意见稿还尤其强调,“以涂擦、喷洒或者其他类似方法,施用于皮肤等人体表面,以清洁、保护、修饰、美化为目的的日用化学工业产品,按照化妆品管理”。意在进一步划清医疗器械与化妆品的界限。
华熙生物注册事业群总监刘旭表示,意见稿的出台,将会对医用透明质酸钠类产品有更明确的分类,申报注册及市场管理都会更规范,有利于促进行业有序良性发展。“在本次修订草案中,可以说把‘透明质酸’这一应用领域非常广的成分,进一步进行了规范,也更符合当下的实际市场需求和监管趋势。”
此外,意见稿中“作为注射到真皮层,主要通过所含透明质酸钠的保湿、补水等作用,改善皮肤状态应用时,按照第三类医疗器械管理。”这一规定,则被业内解读为“水光针转正”。
仅批了30个
众所周知,此前“械字号面膜”在市场上十分泛滥,各种医用冷敷贴、透明质酸钠敷料等产品均打着“医用面膜”的旗号横行。不过,近年来,由于全国各地对于“械字号”产品的严管,上述现象已得到了遏制。青眼在各大电商平台上搜索“透明质酸钠 敷料”发现,相关商品大多持有二类医疗器械注册证,一类产品已难寻踪迹。
青眼以“透明质酸”为关键词在国家药监局境内医疗器械(备案历史系统)中查询,也仅显示了6条记录。

“一类透明质酸钠敷料产品早就没有人做了,大家现在都在做二类的,只是现在想拿到证并不容易。”湖南新谐康医疗器械有限公司合伙人俞志明向青眼介绍,由于二类透明质酸钠敷料产品并不在《医疗器械分类目录》(2017年版)里,所以很多省份不批,只有湖南、黑龙江等少数省份批了一部分产品。
事实确实如此,青眼以“透明质酸”为关键词在国家药监局境内医疗器械(注册)中查询,共显示有180条记录,这其中还包含了近50个三类产品以及“透明质酸检测试剂盒”“医用透明质酸钠凝胶”“透明质酸钠润滑液”等产品。二类透明质酸钠敷料(含修复贴)的产品仅约30款。

广州昕生医学材料有限公司总经理杨伟红也表达了类似的观点,“在二类透明质酸钠敷料的审批上,各地的尺度都不一样,譬如,广东省到目前为止,就一个都没批。若意见稿最后能落地,那就说明各地都可以放开了。”
不过一位不愿具名的业内人士则认为,“即便意见稿落地,也不等同于全面放开,管得严的省份还是会卡,除非是二类透明质酸钠敷料写进了《医疗器械分类目录》。”该人士也表示,“整体形势将要比目前‘松’一些。”
虽然,目前获得二类透明质酸钠敷料注册证的产品不多,但是透明质酸钠敷料的市场却较为繁荣。在天猫平台上以“透明质酸 敷料”为关键词进行搜索,共显示有1223件相关商品,销量排名前三的产品的月销量均超过了1万件。
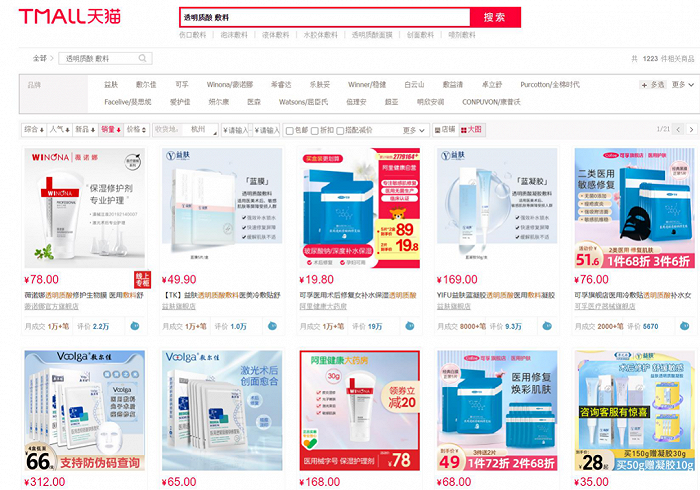
并且,敷尔佳还要借透明质酸钠修复贴冲击资本市场。根据敷尔佳招股书显示,敷尔佳早在2014年研发出“医用透明质酸钠修复贴(二类)”,2020年该公司仅医用透明质酸钠修复贴的收入就超过8亿元。然而,招股书显示该公司的研发人员仅3人,也饱受争议。
面膜市场将遭遇新一轮冲击
目前透明质酸钠(玻璃酸钠)产品除了在药品、医疗器械应用外,还常用于化妆品、食品等领域,部分产品用途介于药品、医疗器械、化妆品边缘。也是基于此现状,国家药监局对医用透明质酸钠进行重新归类管理,明确医用透明质酸钠该怎么用、怎么管,将利于全国统一。
从医用敷料市场来看,据弗若斯特沙利文报告显示,中国医用敷料的市场规模从2017年的67亿元增至2021年的259亿元,复合年增长率为40%,未来预计将从2022年的347亿元进一步增至2027年的979亿元,预计复合年增长率为23.1%。
据多位行业人士介绍,目前办理二类透明质酸钠敷料注册证的成本约为20万元左右。俞志明表示,公司已取得了2个透明质酸敷料的二类医疗器械注册证,每个产品的获证成本约为20万元,一个产品需要花费1到2年的时间才能完成注册。“这个成本并不包括厂房建设、前期研发等,仅是办证过程所需的费用。如果加上厂房建设等投入,则需要400万元左右。”
山东一位不愿具名的械字号厂家负责人也表示,不同的产品还需要临床评价或临床试验,来验证产品的安全性和有效性,需要大量的科研人员和技术资料来支持。“‘二、三类医疗器械’的分类不仅仅是对产品的标准,还意味着GMP标准车间、健全的质量管理体系、专业的人员参与运营,这是考验企业的管理能力、研发能力、供应链能力和商业化能力,而这些能力也需要企业有持续性的投入。”
虽然二类透明质酸敷料具有一定的门槛,但前景可观,想分一杯羹的企业在不断增加。医用敷料也逐渐蚕食了一部分面膜市场,进入到了价格战阶段。
“估计意见稿正式落地后,将会有更多的产品获批。”杨伟红也称,从另一角度来看,这也可能会对面膜市场造成一定的挤压。
由于前期受到了不正确的市场教育,在消费者心智中,敷料贴已经和面膜划上了等号。因此,随着二类透明质酸钠敷料开放,也需警惕“医美面膜”卷土重来,对化妆品行业造成二次伤害。




评论