文|氨基财经
自第一三共的DS-8201引爆ADC赛道以来,众多玩家蜂拥而入。
虽然ADC药物研发壁垒更高,但也不可避免的卷了起来。在这种情况下,如何通过差异化打法破局,并巩固自身优势,无疑值得考虑。
那么如何做到差异化?联合用药为我们提供了一种解题思路。
理论上,ADC能够和免疫检查点抑制剂、化疗、抗血管生成剂等多种疗法联合用药,且还有1+1>2的可能。
相比于单药的人山人海,ADC联合用药还是一块待开垦的肥沃土地。如何在众多选择中找到最佳搭档?

考验各大药企实力的时候到了。
01 ADC+免疫抑制剂,最火热的联合疗法战场
DS-8201已经证明了ADC单药的炸裂效果,不过ADC的想象空间还不仅限于此。单药之外,联合疗法也具备极大想象空间。
目前,不仅是海外巨头,包括国内的荣昌生物、恒瑞医药、科伦药业、瓴路药业等多家药企,均开展了ADC药物联合疗法的探索。
最为火热的路线是ADC联合免疫检查点抑制剂,这也是ADC联合疗法的主战场。原因不难理解,ADC药物与免疫检查点能够相辅相成。
我们知道,PD-1/PD-L1、CTLA-4等多种免疫抑制剂的发展,开启了免疫治疗的新时代,但各类免疫抑制剂总体效果并不尽如人意。例如,PD-1单药效果相对有限,大部分癌种仅有20%-30%的患者存在免疫应答。
问题出在肿瘤微环境上。根据肿瘤微环境的不同,我们可以将肿瘤分为冷肿瘤和热肿瘤。
其中,热肿瘤包含大量的浸润T细胞,对免疫检查点抑制剂有着更高的响应率,而冷肿瘤则相反,对免疫检查点响应率较低。
所以,要想增加PD-1响应率,就要增加对这些免疫冷肿瘤的浸润,或将“冷”肿瘤转化为“热”肿瘤。
目前看,ADC就具备加热肿瘤的能力。有临床试验发现,第二代ADC药物T-DM1和CTLA-4/PD-1单抗的联合治疗,能够同时触发先天性和适应性免疫,导致大量的T细胞浸润。
此外,ADC还可以诱导免疫原性细胞死亡。免疫原性细胞死亡是一特殊的细胞死亡形式,能够刺激免疫反应,针对死亡细胞所表达的抗原产生相应的免疫应答。
这一细胞死亡形式用在癌细胞身上,就会在杀死癌细胞的同时,诱导抗癌免疫和形成免疫记忆。这样一来,在没有任何额外治疗的情况下,人体也能够抵抗肿瘤复发的挑战。
而ADC介导的免疫原性细胞死亡和肿瘤浸润淋巴细胞的募集,能促进免疫效应细胞对免疫冷肿瘤的识别、活性。
并且,在ADC药物促进免疫治疗活性的同时,免疫检查点抑制剂也能增强ADC药物的活性。一项在小鼠中进行的临床试验表明,CTLA-4单抗可以增强ADC对乳腺癌的杀伤力。
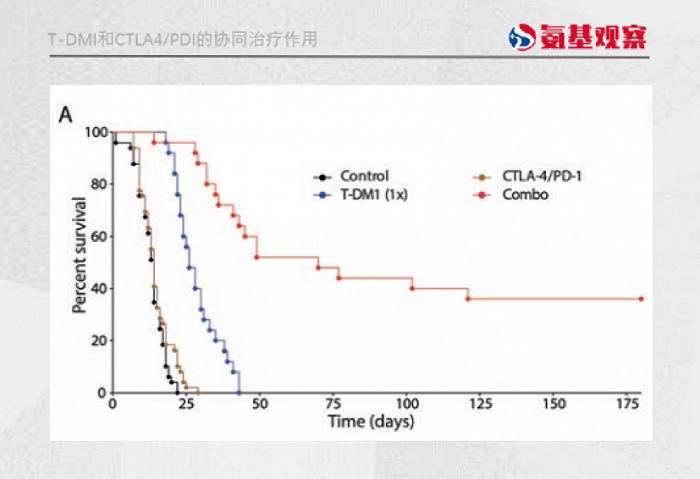
这正是ADC能够与免疫抑制剂互相成就的基础,也是吸引各药企入局的关键。
02 “亦正亦邪”的联合疗法,突围还需更多探索
当然,上述也仅是基于理论基础来说明ADC+免疫抑制剂联合疗法的潜力。在医药研发领域,理论与现实之间,往往存在着一道道需要跨越的屏障。
ADC药物与免疫抑制剂联合用药的探索,在临床中的实际情况也必然会极为复杂。
在一些临床试验中,ADC与免疫检查点抑制剂联合的确收获了1+1>2的效果。比如,在一项评估K药与第二代ADC药物T-DM1联用治疗晚期乳腺的一期临床试验中,联合疗法就展示了可喜的效果。
这项试验入组了20名经曲妥珠单抗联合紫杉烷治疗无效后的晚期转移性乳腺癌患者。
在接受T-DM1联合K药的治疗后,在PD-L1表达<1的亚组中患者客观缓解率达到29%,中位无进展生存期为 2.9个月,而PD-L1表达≥1的患者,客观缓解率则达到了33%,中位无进展生存期为8.7个月。

不过,并非所有ADC与免疫检查点联合都能收获更好的效果。
在一项名为KATE2的临床试验中,PD-L1与T-DM1的联合使用,就没能够给晚期乳腺癌患者带来更好的疗效。
在这项实验中,与单独使用T-DM1相比,PD-L1与T-DM1的联合方案给HER2阳性乳腺癌患者的总生存期带来的提升有限,在无进展生存期上也没能显示出益处。并且,PD-L1与T-DM1联合疗法的严重不良事件发生率更高,还出现了患者因为不良事件而停药的情况。
这种1+1<2的情况也并不是个例。
在另一项ADC药物Teliso-V联合O药治疗c-Met阳性NSCLC患者的临床实验中发现,虽然临床试验达到了安全性和抗肿瘤活性的主要目标,但联合疗法在总客观缓解率上的表现却并不理想。
在这项临床试验中,Teliso-V+O药联合疗法的客观缓解率仅为7.4%,还不及K药单药或者Teliso-V单药的客观缓解率。
至于为什么会出现1+1<2的结果,目前尚未有明确答案。
实际上,对于二者联合用药的机制也仍未完全研究清楚,如何让联合用药发挥更好的效果还需要更多的探索。
03 谁是ADC的良配?有待时间给出答案
根据现有ADC药物的效果来看,理论上在联合疗法方面具备多个改进方向,例如增加ADC向组织输送能力、调节抗体靶蛋白表达、促进抗肿瘤免疫等。
也正因此,在免疫抑制剂联合疗法之外,也有诸多药企开展其它方向的尝试。例如,ADC联合抗血管生成剂,目前来看也是联合用药的可行思路。
我们知道,血管生成是实体瘤增殖的必要过程,其中内皮生长因子 (VEGF) 更是肿瘤血管生成方面的重要帮凶。
这也会阻碍ADC药物向肿瘤组织递送,从而影响治疗效果。所以,抗血管生成药物和ADC药物的联合用药,将会起到1+1大于2的效果:
抗血管生成药物能够使肿瘤血管正常化,从而改善ADC向肿瘤组织的递送,增强ADC的细胞毒性作用。

目前,已经有ADC药物在进行与抗血管生成剂联用治疗癌症的临床试验。
比如Mirvetuximab soravtansine(MIRV),这是ImmunoGen公司开发的首个靶向叶酸受体α(FRα)的ADC药物。
在名为FORWARD II的1b期临床试验中,在FRα阳性的患者中评估了MIRV与VEGF抑制剂贝伐珠单抗联合用于卵巢癌的效果。
初步临床数据显示,6例患者出现客观反应,总体客观缓解率为43%;在对33名FRα高表达肿瘤患者的亚组分析中,确认的客观缓解率更高为61%。
这一临床数据也初步说明,MIRV与贝伐珠单抗的组合对复发性卵巢癌患者具备治疗潜力,特别是在肿瘤表达高水平FRα的患者中。
当然,正如上文所说,ADC联合疗法的搭档选择方向较多,也不仅限于免疫检查点抑制剂和抗血管生成剂。目前仍有多种ADC搭档仍然在探索中,ADC联合化疗也是一个热门的搭配。
比如罗氏靶向CD79b的ADC产品 Polivy通过联合化疗,Polivy在一线治疗弥漫性大B细胞淋巴瘤患者的3期临床试验中达到主要终点。
与标准治疗相比,联合疗法给患者的无进展生存期带来了显著改善。这也是近年来,首个相对于标准疗法出现改善的治疗方案。
除此之外,ADC还有一些新颖的搭配。
比如,使用针对ADC靶点的不可逆激酶抑制剂泛HER抑制剂来那替尼,与靶向HER2 ADC联用,能够刺激抗原内化从而加强ADC的内吞作用和活性;
再比如,通过对抑制MAPK通路导致受体酪氨酸激酶AXL上调,从而增强AXL靶向ADC针对黑色素瘤细胞系的活性。
但目前围绕这些联合疗法的临床探索较少,还需要更多的临床验证,才能发现谁是ADC的最好选择。
换言之,相比于ADC单药,ADC联合疗法仍然存在着许多的未知,也存在着更多的可能性。对于国内药企来说,在拥挤的ADC市场想要突出重围,考虑尝试开拓ADC联合疗法,或许也能带来意想不到的效果。




评论