文|MedTrend医趋势
类器官,顾名思义是人体真实器官及生理系统的模拟,作为干细胞研究的重要成果之一,对于临床精准医疗(为患者制定个体化治疗方案)、临床前药物研发等有着非凡价值;因此也成为TOP药企必须拿下的据点。
而在这一辉瑞、艾伯维、强生、罗氏、默沙东、诺华、BMS、赛诺菲、GSK、阿斯利康、武田制药等全球TOP20药企都在争相布局的未来领域,已经有企业拔得头筹。
近日,FDA批准了全球首个完全基于“类器官芯片”研究获得临床前数据的新药(NCT04658472)进入临床试验。这一里程碑事件,意味着“类器官芯片”实验首次取代了传统动物实验,并且正式被官方认可。
这项新药实验由赛诺菲和类器官芯片公司Hesperos合作进行,用于治疗两种罕见的自身免疫性脱髓鞘神经疾病,而在此之前,由于缺乏理想的动物模型,无法针对这些疾病开展研究。
至此,赛诺菲后来居上,虽不是第一个布局,但在“类器官”实践领域超前全场。
如果该项目进展顺利,或将彻底颠覆临床开发的种种限制,改变全球药物研发的游戏规则。
01 为什么美国、欧盟将“类器官芯片”技术提升到国家战略高度?
全球有超过7000种罕见病没有治疗方法,其中只有约400种正在进行研究,很大原因就是缺乏模拟这些疾病的动物模型,肿瘤、心血管等重大疾病也面临相同困局。
如果说有一项技术有望将新药研发带入“低风险、低投入、高回报”时代,那么“类器官芯片”或将是其中之一。
从“类器官”到“类器官芯片”
1907年,44岁的贝克罗莱那大学教授威尔逊发现,通过机械分离的海绵细胞可重新聚集并自组成为新的具有正常功能的海绵有机体,其研究结果于1910年发表,成为最早“类器官”的概念雏形。
此后,随着干细胞技术的飞速发展为类器官研究带来关键契机。2009年,荷兰科学家Hans Clevers团队成功将Lgr5+肠道干细胞在体外培养成具有隐窝状和绒毛状上皮区域的三维结构,诞生首个小肠类器官。
从2009年至今,3D类器官培养技术已成功培养出大部分具有部分关键生理结构和功能的类组织器官,包括:肾、肝、肺、肠、脑、心脏、前列腺、胰腺、视网膜等。并被《科学》杂志评为年度10大科学技术之一。
于此同时,另一项基于微流控技术的器官芯片技术,开始在芯片上研究复杂的细胞行为,构建三维人体器官。
类器官(Organoid)具有高仿真性,与人体器官有高度相似的组织学特征和功能;
器官芯片(Organ-on-a-Chip)在建模的可控性和标准化上具有优势,且可实现更复杂模型的构建。
然而,他们都是由单一种类细胞构建的模型,对于生物学的系统仿生程度依然不够。
2019年,Science杂志发表的综述首次提出了类器官芯片概念。
类器官芯片(Organoids-on-chips)整合了类器官和器官芯片技术路线的优势;在芯片上构建起器官生理微系统,再现相互依赖的器官功能,从而预测人体对药物或外界不同刺激产生的反应。说明已几乎是模拟完整的人体,而不是单个器官。

类器官芯片模拟人体生理微系统
“低风险、低投入”的新药研发?美国、欧盟出台扶持计划
据统计,2021年开发一款新药的平均成本降至近七年最低,仍高达约20亿美元。此外,进入临床开发阶段的新药失败率仍近90%。
以上痛点,主要由于动物模型不足且动物模型并不能准确预测人体反应。
“类器官芯片”因为是直接利用人类组织构建,且可定制化为疾病建模;因此可以在临床实验前更充分的进行效价评估,将不合适的药物排除,从而提升药物研发成功率,降低后期药物开发成本且不伤害动物。此外,类器官芯片叠加AI技术的融合也将使药物筛选更高效、精准。
基于以上原因,2011年美国NIH、FDA和美国国防部牵头推出“微生理系统” 计划(MPS 计划),首次把类器官芯片技术上升到国家战略层面。
与此同时,欧盟也看好类器官芯片技术在新药研发、精准医疗、AI制药领域的发展前景,由其资助的大型研发联盟(imSAVAR)目标之一就是与大型药企合作开发器官芯片模型。
然而此后十年间,类器官芯片大多处于实验室研究阶段,真正在药物研发上的临床应用比较少。原因除了其技术壁垒高、涉及多学科交叉外,最大的“阻碍”仍在于缺乏法规的认可;如今这一“阻碍”已被清除。
02 全球市场:TOP20药企均已直接入场
目前全球类器官芯片市场商业化主要来源于两方面:设备销售和测试服务;年复合增长率29%左右;美国市场占比最大约41%,欧洲约38%。
作为新药研发的重要助力,类器官芯片公司的下游客户主要包括CRO和药企。
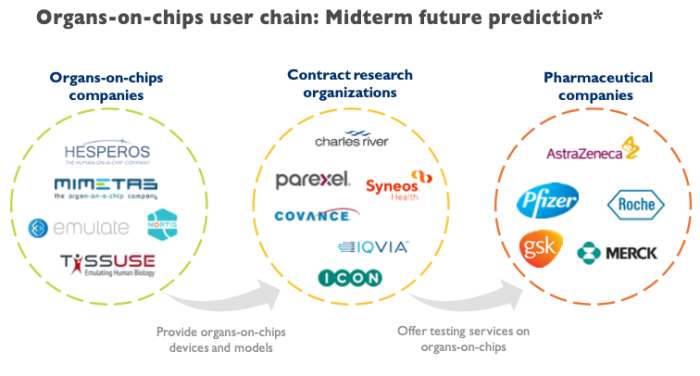
类器官芯片企业主要商业模式
类器官鼻祖Hans Clevers团队成立的HubrechtOrganoid Technology(HUB)是全球首个类器官研发中心,而HUB通过技术授权也助力了Epistem、Cellesce、Crown Biosciences、STEMCELL Technologies等第一批类器官公司涌现。
此外,高校研究院成立的技术公司也是这一类器官芯片公司的主力,例如哈佛大学Wyss生物工程学院2013年成立的生物技术公司Emulate。
此前类器官芯片企业大多通过向CRO出售产品间接为药企提供服务。2015年以后,越来越多的药企通过购买产品、合作授权以及投资等形式直接入场,成为这一领域的另一股力量。
2015年,强生购买Emulate公司的血栓芯片,用于检测其在已上市药物或在研药物中的促血凝特性。
2016年,默克、Seres Therapeutics等购买Emulate公司类器官芯片用于新药研发测试。
2018年,阿斯利康与Emulate公司达成协议,将其类器官芯片技术结合到阿斯利康的IMED药物安全实验室中;阿斯利康也是首家将类器官芯片技术整合进内部实验室的TOP药企。
2018年5月,辉瑞与HUB合作开发人类肠道类器官平台,用来研究克罗恩病、溃疡性结肠炎等疾病。
2018年9月,由辉瑞领投的神经治疗初创公司System1 Biosciences获2500万美元A轮融资,其自研大脑类器官,用于研发神经治疗新方法。
2021年,赛诺菲与Hesperos合作,共同进行NCT04658472临床前研究。
2022年1月,百时美施贵宝与Prellis 达成合作,基于其人体淋巴结类器官平台创建针对人类蛋白质的高亲和力人类抗体。
2022年3月,赛诺菲与Prellis达成合作,利用其平台在体外重建免疫反应以提供具有显着遗传多样性的抗体。
此外,由艾伯维、默克、诺华等20余家TOP药企共同成立非营利组织IQ联盟(Innovationand Quality Consortium),致力于推动类器官芯片的标准化应用,以加速药物研发进程。目前已针对肝脏、肾脏、肺等模型发表一系列行业标准。
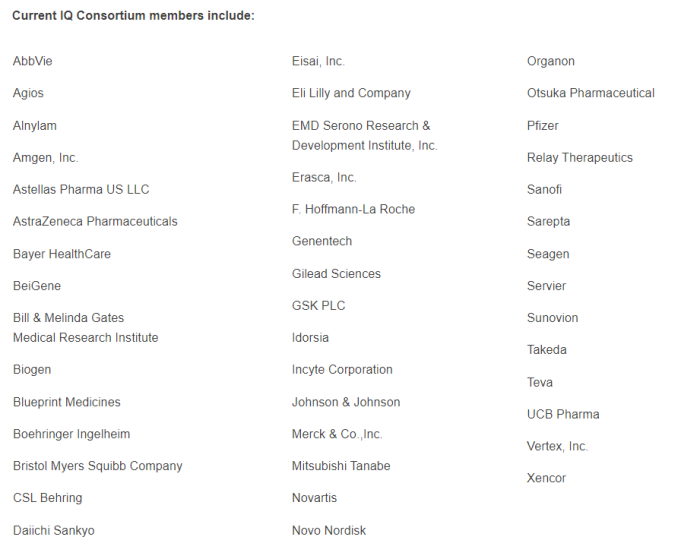
IQ联盟成员药企
03 中国市场:恒瑞、百济;罗氏、默克已领先布局
从2021年起,中国正式从科研和监管层面系统性推进类器官芯片技术的发展。
2021年1月28日,科技部下发《关于对“十四五”国家重点研发计划6个重点专项2021年度项目申报指南征求意见的通知》,把“基于类器官的恶性肿瘤疾病模型”列为“十四五”国家重点研发计划中首批启动重点专项任务。
2021年11月,中国CDE首次将类器官列入基因治疗及细胞治疗的验证指南基因治疗产品非临床药理学研究。
2022年7月,中国首个类器官指导肿瘤精准药物治疗的专家共识面世。
中国类器官芯片发展虽然比美国完了约十年,但是进步速度飞快。
中国科研积累的提升加速相关产业化进程。
2009-2019,在类器官技术相关领域来自于中国的发表文献占8%,位于全球第6;到2020年,来自中国的发表文献已达14%,仅次于美国,位于全球第2。
中国资本市场开始关注类器官企业。
从2019年开始,中国类器官企业开始赢得资本关注,纷纷完成天使轮融资,2021年完成A轮融资,
创芯国际完成近亿元A轮融资,由趣道资产领投;
丹望医疗完成1.2亿元A轮融资,由国方资本领投,德联资本、昆仑资本跟投,并且类器官“鼻祖”Hans Clevers以联合创始人和首席顾问科学家身份加盟;
大橡科技完成数千万元的A轮融资,由鼎晖VGC(鼎晖创新与成长基金)领投,奇绩创坛跟投,老股东药明康德、复容投资及久友资本继续跟投;
从药企来看,中国研发“一哥”和曾经的研发“一哥”都已布局类器官相关领域。
百济神州是IQ联盟里唯一的中国药企,2021年12月,其与创芯国际签署战略合作协议,共同建立类器官新药研发技术平台。
恒瑞医药的转化医学部门,建立了体外类器官培养(organoid culture),可以在模拟的人体器官及肿瘤微环境中进行药物研究;
跨国药企也将中国创新中心项目拓展至“类器官”相关领域。
2020年,默克中国创新中心开始探索创新“类器官”平台。
罗氏中国药物科学部门的重点项目之一是将人体模型系统(类器官和微生理系统)应用到药物发现产品管线中。
随着FDA此次里程碑式获批,未来中国NMPA或也将实现以“类器官芯片”数据获批新药临床试验。第一个获批的企业会是谁?




评论