文|氨基观察
万物皆可偶联,早已不是一句口号。
全球范围内,火爆的ADC赛道之外,多肽偶联药物(PDC)、核素偶联药物(RDC)、抗体片段偶联药物(FDC)、抗体细胞偶联药物(ACC)、抗体寡核苷酸偶联物(AOC)、抗体偶联SiRNA在内的多种偶联药物,研发如火如荼。
国内企业也是参与其中。例如,在RDC领域,远大医药、智核生物、核欣医药、先通医药、辐联医药、健元医药等多家药企参与其中。
不仅是RDC,包括PDC等众多领域,参与者同样不乏国内药企身影。这其中,必然会诞生重磅炸弹药物,但可能还需要时间。
例如,PDC研发领域就频频遇挫。先是Bicycle临床产品数据不给力,股价持续下跌;又是“唯二”上市的PDC药物之一Pepatxo,被FDA下架已成定局。
近日,FDA 肿瘤药物咨询委员会以14:2的投票,反对Pepatxo用于治疗难治性/复发性多发性骨髓瘤患者。
事实上,PDC药物的研发困境,只是“万物皆可联”赛道的一个缩影。今年以来,AOC、ISAC、抗体偶联SiRNA、双抗ADC接连失败。
这也告诉我们,“万物皆可偶联”的梦想要想成为现实,还需要跨过重重障碍。对于众多药企来说,这是挑战,但也是机会。
/ 01 /上市8个月被下架背后,疗效不及对照组
偶联药物家族的结构大同小异。
例如,上文提到的PDC,和当下火爆的ADC药物就极为相似。ADC是由抗体+连接子+毒素三部分构成。PDC的改变在于,将“抗体”换成了“多肽”。
多肽,也可以特异性靶向肿瘤细胞表面的蛋白受体,从而传递细胞毒素诱导肿瘤细胞凋亡。
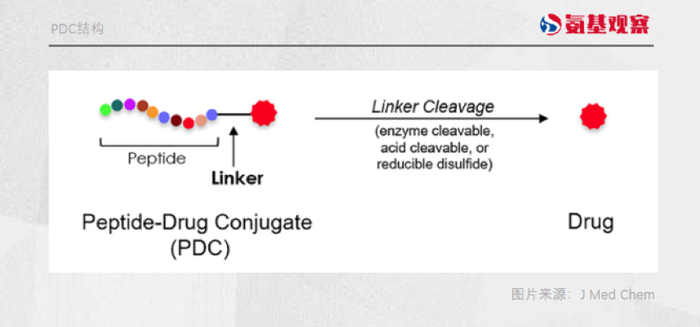
当然,不同偶联药物因为结构的差异,治疗理念不尽相同,效果也会有所差异。
例如,PDC药物使用多肽靶向定位系统,能够成为“靶向化疗”产品,前景似乎不逊于ADC药物。
我们知道,由于抗体的分子量较大,所以ADC药物穿透实体肿瘤的能力被限制。近年来ADC获批的适应症大多是针对血液恶性肿瘤,实体瘤的突破主要在乳腺癌。
与抗体相比,多肽的分子量要小得多,因此具有较强血管、组织和细胞的通透性,易渗透到肿瘤深处,能够对实体瘤产生更好的效果。
并且,较小的分子量也决定了PDC药物不太会引起免疫原性反应,所以能够在肿瘤内达到更高浓度,以高效杀伤肿瘤细胞。
理论上,PDC还具备“减毒”的功效。由于PDC药物的分子量较小且亲水性高,所以其能够通过肾脏快速排出,减少在体内的蓄积,展现出更好的安全性。
此外,相较于抗体,多肽的生产工艺更简单、成本更低,因此基于多肽研发的PDC生产过程也更简便、易于规模放大。
连接子方面,PDC的选择与ADC大致相同。而在毒素的选择上,PDC的选择性比ADC更多阿霉素、紫杉醇等毒性相对较低化疗药物,都可以作为PDC的毒性弹头。
综合来看,PDC药物看点的确不少。正是基于此,这一赛道吸引众多国内创新药企入局,包括盛诺基医药、泰尔康生物、同宜医药等。
当然,PDC药物的潜在优势,还只是基于理论基础,现实的情况要比想象中的复杂。在PDC赛道,折戟的玩家不在少数。
率先尝鲜的Oncopides公司,遭遇了产品上市不到一年就退市的尴尬。
2021年2月,Oncopides公司的PDC药物Pepatxo获FDA加速批准上市,适应症为与地塞米松联用治疗三重难治性/复发性多发性骨髓瘤患者。
这是全球第二款获批上市的PDC药物。理想情况下,Pepatxo的成功会给整个PDC赛道带来希望。但实际情况却是,获批上市不到8个月,Pepatxo的生命就走到了尽头。
在名为Ocean-3的三期临床试验中,治疗组无进展生存期和客观缓解率都优于泊马度胺,但是在生存期上,Pepatxo表现却不如泊马度胺。
使用Pepaxto的患者中位生存期为19.7 个月,而泊马度胺的中位生存期为25个月。
更重要的是,与接受百时美施贵宝泊马度胺加地塞米松的患者相比,接受 Pepaxto和类固醇地塞米松治疗的患者死亡风险高10%。
这直接导致Pepatxo被FDA下架。2021年10月22日,Oncopeptides宣布在美国市场撤回Pepaxto此前获批的适应症。
/ 02 /申诉失败、领头羊临床数据不佳,PDC赛道水逆2022
对于PDC赛道来说,2022年依然水逆。
Oncopides公司并没有彻底放弃治疗,而是希望说服FDA撤回Pepaxto退市的决定。
原因在于,Oncopeptides在亚组分析中发现,虽然年轻人使用泊马度胺的存活率更高,但是对于老年人来说,使用Pepaxto的存活率几乎是泊马度胺的两倍。
正因此,Oncopeptides 决定“搏一搏”,毕竟美国市场这块大蛋糕谁都不想丢。
但FDA对此并不买账。FDA肿瘤药物咨询委员会以14-2的投票结果拒绝了这一亚组分析的结果。
FDA的大佬 Richard Pazdur 博士,更是直接抨击了Oncopeptides的亚组分析,认为这是事后为了达到效果而刻意划分的亚组,并不具备意义。
实际上,Oncopeptides的遭遇,只是PDC赛道遇冷的一个缩影。
今年4月份,这赛道的行业另一领导者Bicycle,多款产品都没有在毒副作用方面得到改善,市值也由高点的近20亿美金,缩水至7亿美金。
很显然,PDC药物的研发,并不如想象中的一般容易。
的确如此,虽然PDC药物的小分子量能够帮助其穿透实体瘤、降低免疫原性,但正所谓成也萧何败也萧何。
与抗体相比,多肽对靶蛋白靶受体的特异性并没有那么强,所以PDC的靶向性可能不及ADC。这也对最终的疗效造成一定影响。
这一问题也有解决之道。上文提到的Bicyle给出的解题思路,是利用双环肽技术增加了靶向特异性。
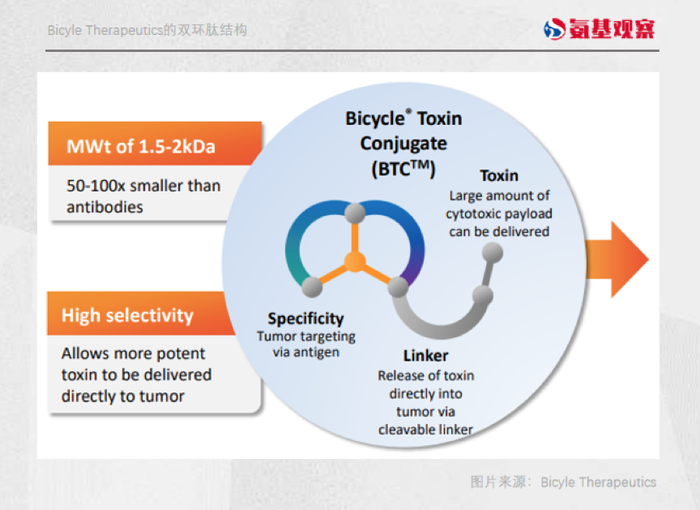
但是,Bicyle没能带来更好的效果,其研发药物因为治疗窗口过窄的问题,导致疗效有所限制,且毒副作用问题依然严重。
例如,公司靶向Nectin-4的PDC药物BT8009的临床试验结果并不算好。
今年4月,BT8009在AACR年会公布一期临床数据,虽然BT8009在疗效上与同靶点ADC药物Padcev相差不大;但安全性处于劣势,接受BT8009的患者血液中存在更多的MMAE毒素。这也导致,Bicyle公司股价遭遇了一波大跌。
很显然,PDC药物想要迈向成功还有许多问题待解决。
/ 03 /万物皆可偶联,但家家有本难念的经
PDC的困境,只是偶联药物研发的一个缩影。事实上,今年以来已有不少新一代偶联药物翻车。
在Oncopides AB公司被FDA敲打之后,抗体偶联SiRNA也遭遇打击:9月27日,由于严重的副作用,FDA要求AOC1001的1/2期临床停止新患者入组。
这也不意外,偶联药物并非简单的老药、老靶点的组合,每种偶联药物都有着自己的技术瓶颈,突破并不容易。
抗体偶联SiRNA的研发仍然有许多问题有待解决。比如,抗体偶联SiRNA不容易进入细胞、抗体与SiRNA结合产生的空间位阻会降低结合效率等问题都还没有解决方法。
不仅是抗体偶联SiRNA,此前其也被不少人看作是下一代偶联药物希望ISAC药物,也遭遇了接二连三的失败。
前有Silverback Therapeutics的ISAC药物研发折戟,后有Bolt Therapeutics的ISAC药物BDC-1001的1/2期临床数据不及预期。
失败的背后是因为,同样是研发不够到位的问题。
尤其是激动剂的选择问题,目前仍然无法解决。激动剂的活性太强,会带来难以承受的副作用;激动剂的活性太弱,虽然能降低副作用但没什么药效。
选择一个合适的激动剂在保持药效的同时控制好毒性,是ISAC走向成功必须要跨越的难题。
而在ADC领域,包括前抗体ADC、双抗ADC也是黑天鹅连连。显而易见,“万物皆可联”还很遥远。
当然了,倒也不必因为几次临床的失败,就感到沮丧。
科学转化从来不是一件简单的事情,新技术的发展一直都是螺旋上升的,哪怕是如今已经成熟的ADC技术,也是在经过几十年的摸爬滚打后,才有了今天的成绩。
新一代偶联药物亦是如此,想要真正做到万物皆可偶联,仍然任重道远。但背后的价值,也不言而喻。



评论