文|动脉网
长生不老是人类亘古不变的追求之一。
秦始皇时期就有长生仙丹的冶炼,到现代技术通过各种方式延长人的寿命。在医学延长人类寿命上,可以分为三个阶段:
第一阶段,化学工业把人类的生命延长约20岁到30岁。第二阶段,生物制剂又将寿命延长10岁至20 岁,第三阶段,细胞、材料、基因、组织工程技术又将把人类的生命又延长10岁至20岁,这即是再生医学的阶段。
与传统的药品和器械治疗受损组织方式逻辑不同的是,再生医学是对人体受损组织进行整体性、系统性替代。
核心观点

● 化学诱导、成体干细胞等基于全新细胞改造平台的新产品会陆续涌现
● 再生材料按不同医疗应用领域进行材料改性、深度联合开发将成趋势
● 组织工程领域具体商业化落脚点或在未来3年逐渐明晰
●未来10年,超过50%的人体组织和简单类器官会出现商业化产品
●传统医疗器械、AI技术等细分领域将逐渐向再生医学行业延伸、融合
再生医学是利用生命科学、工程学、计算机科学等多学科的理论和方法,融合材料科学、细胞技术、组织工程技术、基因工程技术等多项现代生物工程技术,实现修复、替代和增强人体内受损、病变或有缺陷的组织和器官的技术。
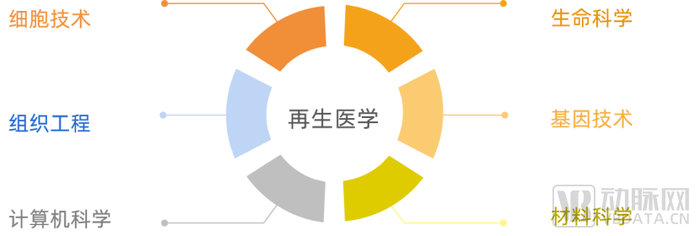
蛋壳研究院通过对我国再生医学赛道的专家的采访调研,我们筛选狭义的再生医学范围主要涵盖组织工程、再生材料、干细胞领域,本报告将主要围绕上述三个赛道讨论。
细胞技术:干细胞在医疗领域应用广泛,部分管线已进入临床
在人类众多束手无策的复杂疾病领域中,例如糖尿病等慢性疾病、帕金森氏综合征等神经疾病以及组织器官诱导再生领域,干细胞技术拥有广阔的空间,亦是再生医学里不可忽视的重要底层技术之一。
干细胞的发展历史不过百年,科研上在近代才取得重要突破。1999年,Science杂志评定并公布了十大科学进展,其中胚胎干细胞的研究名列十大进展的榜首。同年,中国第一个干细胞发明专利授权立项,开启了我国成体干细胞产业的新时代。
免疫细胞竞争日益激烈,干细胞赛道扬帆起航
与竞争激烈的免疫细胞领域相比,干细胞赛道正埋首积蓄力量。相比于免疫细胞,干细胞中外研究进度差距更小。目前研究最多的间充质干细胞(Mesenchymal stem cells,MSCs)全球批准的产品共有10种,根据作用机制和批准的适应症,MSCs产品可分为两大类:组织修复和免疫调节。
从我国来看,目前细胞技术领域的公司产品管线覆盖的适应症广泛,进入临床试验阶段的产品管线对应的适应症较多集中于免疫系统、呼吸系统、神经系统(退行性疾病)等方向。
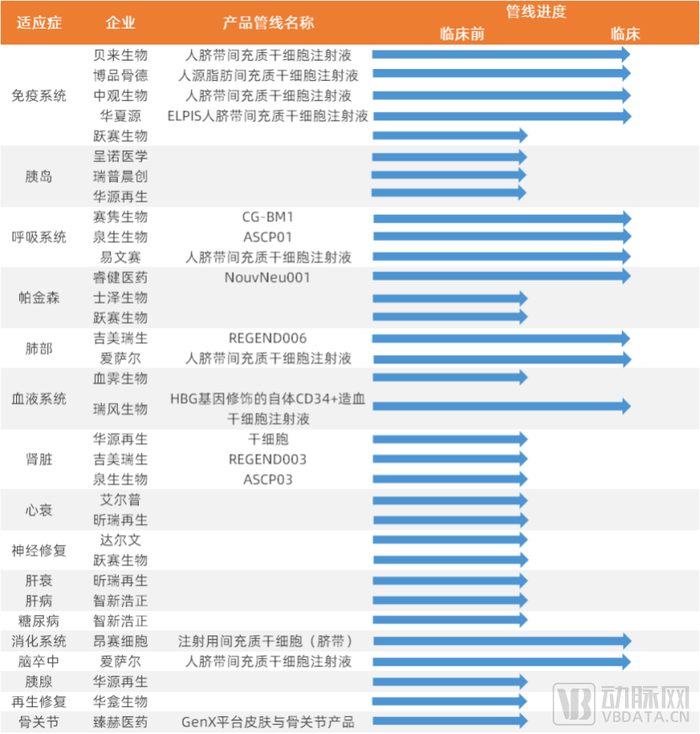
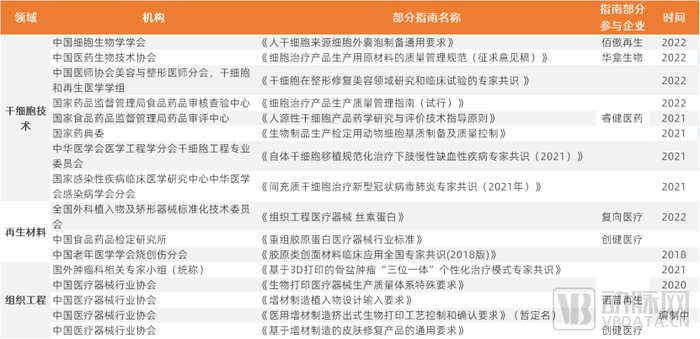
干细胞技术领域部分公司管线进度名单(中国)
从2022年上半年看,国家药品监督管理局药品审评中心共受理了135个细胞治疗产品的各类申请。在这135个申请中,70个为CAR-T,25个为其他类型的免疫细胞治疗;31个为间充质干细胞,数量仅次于风口上的CAR-T。
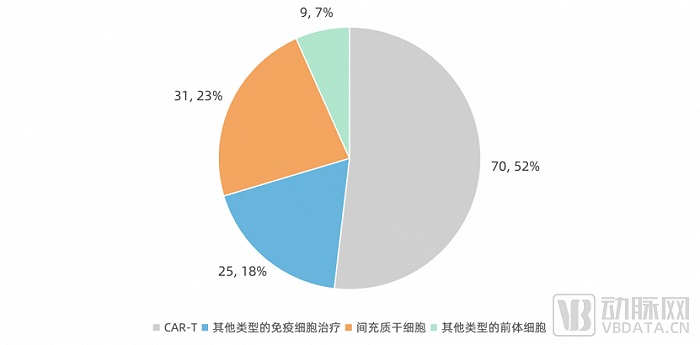
细胞治疗产品CDE受理技术路径数量分布
干细胞中间充质干细胞以其强大的分化再生能力以及免疫调节作用成为近年来的研究热点。
人工智能(AI)等技术与干细胞研究结合,增添效能
随着生物数据的爆发式增长、计算能力的提高、下一代体外模型、生物实验室自动化等发展,越来越多有影响力的案例表明应用人工智能的机会正在成熟。在技术路径中,部分企业正在选择依靠人工智能(AI)高效赋能干细胞研发。
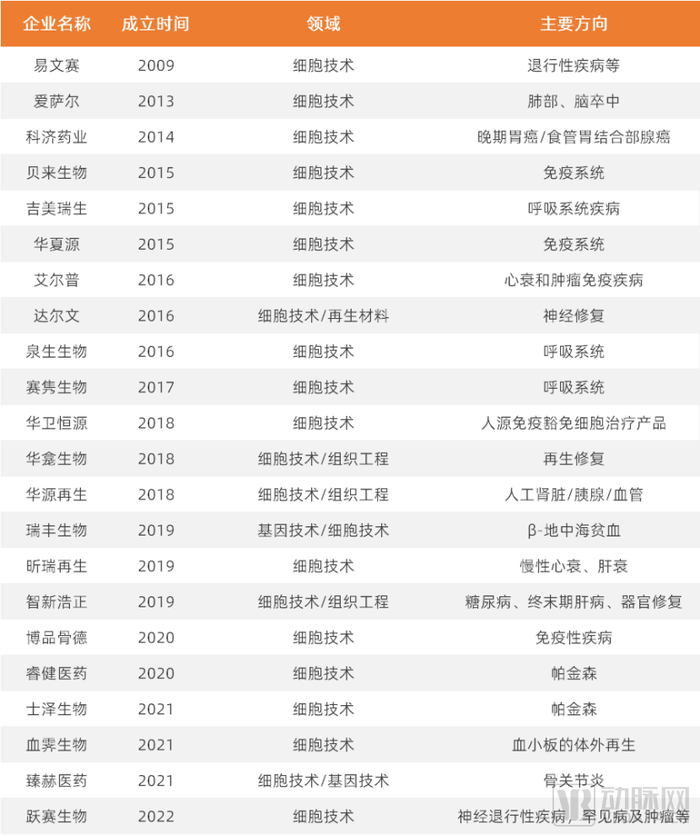
干细胞技术领域部分公司(各公司技术及特点请参阅报告正文)
在研发与开发中嵌入数字化和解析学,对于促使项目成功和为患者提供价值至关重要。人工智能和先进分析将通过提高速度、减少临床失败、降低整个研发价值链的成本以及实现可持续的技术平台,成为提高细胞疗法价值链研发投入回报的重要推动者。
再生材料:创新技术为材料,开辟更多可能,应用场景成熟
生物医用材料在组织修复及再生医学中需要具备3个关键特征:
第一,材料须具备生物相容性或生物安全性,具有较低的宿主免疫反应,可支持或提高细胞生命活动促进组织修复再生;其次,材料具有适当的结构和良好的通透性,支持氧气、营养素运输,实现并维持细胞间的相互作用;第三,对再生修复材料需具有生物降解性或吸收性,降解速率应与组织再生速率相匹配。
目前临床及临床前研究中涉及的再生材料的种类,主要有天然高分子、合成高分子、无机材料三大类,每种类型的代表材料在临床应用上均具有各自的优势性能。

再生材料部分代表种类的优势对比
从材料的发展历史来看,历经从第一代生物材料到第二代生物活性材料后,20世纪90年代后期随着再生医学的兴起,具有诱导再生性能的第三代生物材料成为了当下研究热点。这类材料能够内源性诱导细胞分裂,实现组织再生。
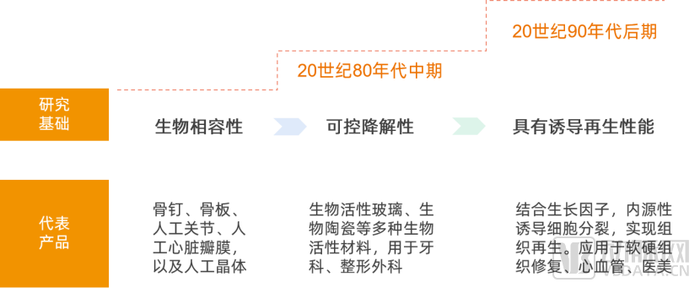
再生材料发展历史
第三代生物材料可以应用于皮肤缺损修复、软组织修复、关节软骨修复、血管及导管涂层应用、医疗美容等,具有极大发展潜力。
与其他属性的生物材料相比,生物再生材料具有许多突出的优势。目前我国再生材料行业企业主要应用材料有复合透明质酸、胶原蛋白、聚乳酸、丝素蛋白、脱细胞基质等。
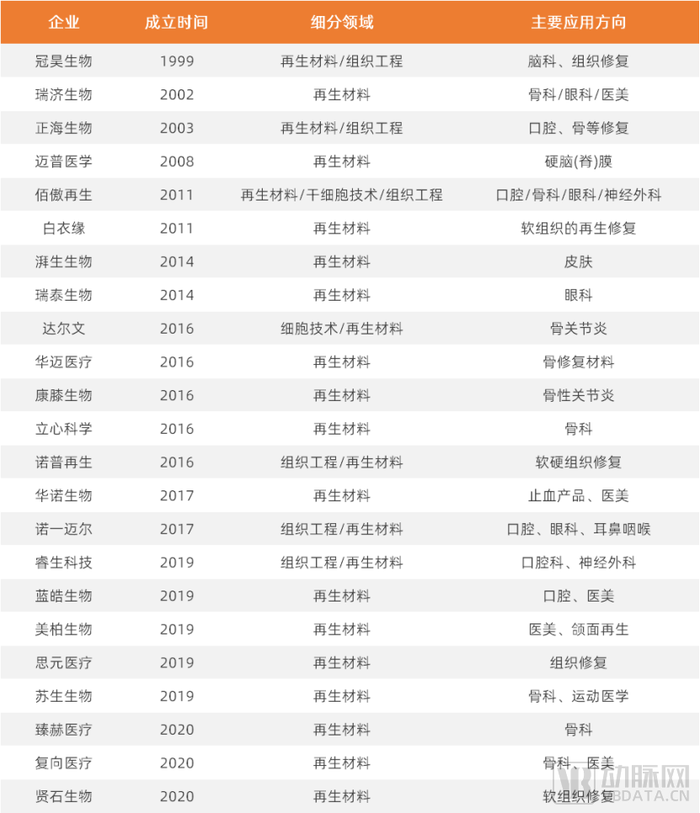
再生材料领域部分公司名单(各公司技术、特点请参阅报告正文表格)
胶原蛋白:再生材料企业的研发与临床中,成为行业的高频选择
2022年是胶原蛋白走进时代聚光灯下的一年。
8月,华熙生物举办胶原蛋白产品发布会,正式对外发布其推出的动物源胶原蛋白、重组人源胶原蛋白等胶原蛋白原料产品。11月,巨子生物成功登陆港交所,此前亦有锦波生物北交所IPO。同时药企出身的江苏吴中也加速入局,其自研的修复敷料即将推出,利用III型重组人源化胶原蛋白,可满足敏感肌修复和光电医美术后修复需求。此外据爱美客的年报显示,爱美客也正在积极开展基因重组蛋白研发的项目。

胶原蛋白领域部分代表企业及其技术
目前胶原蛋白在医学应用领域最为成熟的有皮肤医学、生物膜、生物补片、医美产品等。
其中骨科、心血管未来市场广阔,但从成熟度来看产品管线多为在研。以骨科为例,骨修复胶原可和羟基磷灰石结合,同时在半月板再生、跟腱替代和再生、前交叉韧带重建方面胶原蛋白均有广阔的应用空间。而神经内科、子宫内膜、耳科骨膜等领域市场规模相对骨科、医美较小,但未来增长潜力较大。

胶原蛋白应用领域成熟度与市场规模
聚乳酸:生物降解、性能优良,共聚物打开再生材料应用的创新蓝海
在生物相容性上,聚乳酸对人体有高度安全性并可被组织吸收,加之其优良的物理机械性能,在体内能用作药物控释载体、牙科材料、骨科材料、眼科植入材料以及组织工程支架材料等。
在骨科领域,随着各种增强技术的运用和PLA分子量的提高,以可吸收螺钉为例,通过PLA(聚乳酸)/HA(羟基磷灰石)复合而成的新型螺钉相较于传统骨钉具有更好的固定及高再生诱导活性。
在近二十年的发展中,基于聚乳酸已制备出能够满足各种松质骨乃至皮质骨固定需要的各类PLA内固定产品,如接骨板、螺钉、骨组织支架材料、复合人工骨、接骨板膜垫等,整体来看我国聚乳酸在骨科的应用还处于行业成长初期。
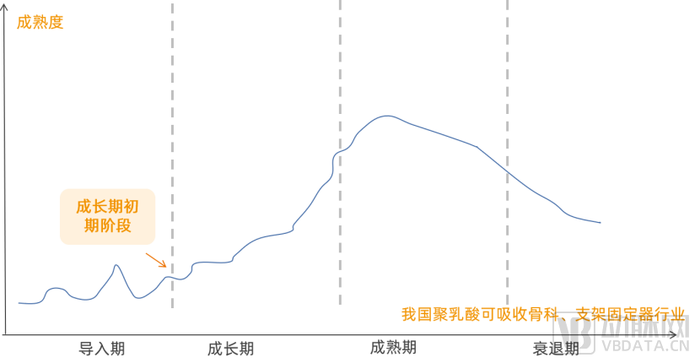
聚乳酸应用在骨科的发展阶段
聚乳酸的技术核心在于微球的制备技术,即微球的尺寸。如果微球过大,会导致植入体内后不良反应的发生;如果微球过小会面临被巨噬细胞吞噬,导致产品功能无法实现的效果。此外,微球自身的制备技术可能会导致微球的形态、密度不同的区别。
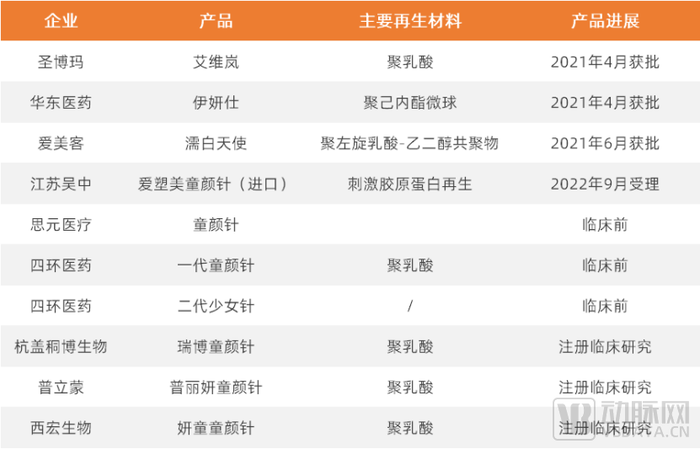
国内部分再生医美产品
丝素蛋白:经典材料的全能梦工厂——运动医学、医美护肤、脑机接口
丝素蛋白因其来源于蚕茧,具有良好的生物相容性,良好的细胞粘附性,可诱导细胞分化和组织再生,同时具有生物降解性,可减少炎症和二次手术风险。
虽然来源于昆虫蛋白,但蚕吐丝部位相对独立,蚕丝中并无细胞,其是一种不含杂蛋白的纤维状长链蛋白质。同时,由于丝素蛋白的一级结构即氨基酸序列中,不存在类似胶原蛋白中的特征端肽,所以在用作人体植入再生材料时,不需要进行去端处理,便可在人体内表现出极低的免疫原性。

丝素蛋白主要技术
根据丝素蛋白相关企业的调研访谈,在再生医学中,目前该材料主要应用的方向为组织工程修复。组织工程修复的目标之一是在具有独特三维结构的可降解材料,将其内部植入人体活细胞,并利用支架负载的生长因子辅助机体再生,再生的组织或器官可以用来修复或是替代受损伤的组织或器官的功能。
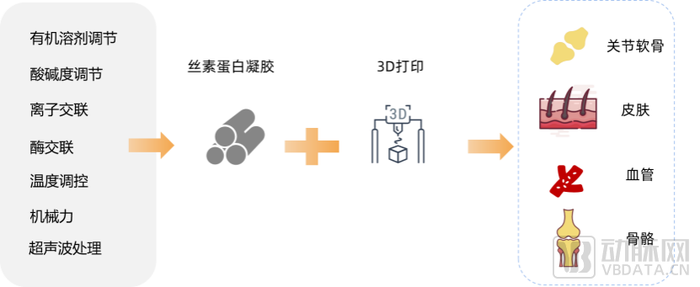
丝素蛋白在医疗领域中目前应用于止血材料、人工软骨/韧带、丝素蛋白骨钉、人工脑膜、心血管支架等方向。
组织工程:技术优势明显,与材料科学、细胞技术融合发展
在人体组织的修复、复制中,如果说细胞技术提供了“内容”,再生材料提供了“支架”,那么组织工程即涵盖了内容与支架及其结合制造的过程。
3D生物打印是组织工程实现的重要路径。
自21世纪初第一台生物打印机开发以来,生物打印已经应用到生产病理模型、药物筛选组织设计、软硬组织和器官再造等领域。
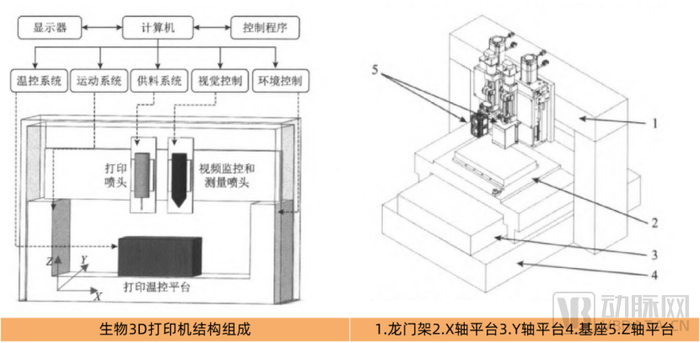
生物3D打印机结构组成,图片来源:中国组织工程学会
全球每年大概有200万人需要器官移植,全球平均器官供需比为1∶20-1∶30;中国每年约有30万患者因器官功能衰竭需要器官移植,但每年器官移植手术仅为1万余例,器官移植存在供需的极度不平衡。而生物3D打印为组织的缺损、器官的供应提供了另一种可能。

生物3D打印市场规模 数据来源:SmarTech
自体、异体移植均存在手术风险高、移植组织来源有限的劣势。3D生物打印是在传统组织构建方法上的显著革新,可实现高精度、高复杂度的宏观与微观打印,同时具有良品率高、个性化等优势。
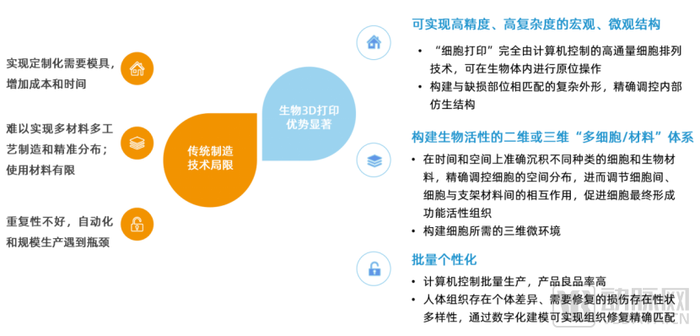
3D生物打印最早被用于制作医疗模型和定制康复医疗器械等方面,目前从医疗3D打印应用领域来看,产品范围覆盖研究和治疗两大领域,细分赛道涵盖广泛,涉及骨科植入、口腔修复、体外模型、术前规划、心血管外科、组织工程支架、组织移植器官、颌面外科、眼科、神经外科等。

组织工程支架材料优缺点
目前从生物3D打印领域企业发展的进程来看,总体海外企业呈现领先优势,根据不完全统计,目前美国生物3D打印赛道共有133家实体服务商,其中47家是硬件(生物打印机)制造商,41家是材料(生物墨水)供应商,59家服务提供商(包括大学生物打印实验室),国际差距日益缩小。
组织工程领域部分代表企业,再生医学产业链及商业化探索
细胞上游培养基等商业模式相较中下游更成熟
干细胞医疗产业链的发展涉及干细胞存储、干细胞药物开发、干细胞治疗,根据QYResearch的研究数据,2020-2026年,中国干细胞医疗产业市场规模复合增长率约为15%,未来几年,中国干细胞医疗产业市场规模在全球市场规模中的占比将进一步上涨。预计到2026年,中国干细胞医疗产业市场规模将达到325亿元。
上游为器械耗材,中游为干细胞药品研发,下游为干细胞应用市场包括医疗机构和医学美容院等。目前我国干细胞治疗行业应用领域还未完全开发,产业链下游应用市场有极大的发展空间。
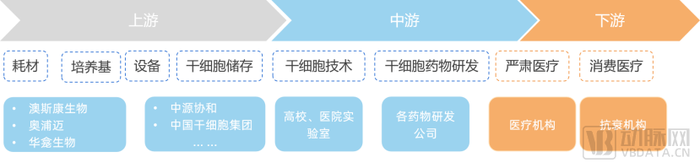
相较于细胞储存业务,上游培养基环节壁垒较高,但目前国内市场中主要由外企占领一半以上的市场份额。根据研究显示,中国细胞培养基市场竞争格局中,以进口品牌为主,市场中的主要竞争者为三大进口厂商即赛默飞、丹纳赫和默克,占据了超过 60%的市场份额,但随着国产品牌的技术突破、国际贸易制裁加剧,龙头市场份额增速近两年逐渐下滑,国产替代正加快拓展中。

从下游客户的需求看,定制化开发培养基需求正在不断增加。拥有定制化能力的上游服务商正在采用根据客户需求开发培养基的策略,达到提高生物药产率、降低生物药生产成本的目的。
再生材料产业链中游研发机构推动下游市场变迁
再生材料产业链上游为原料生产供应企业,中游为技术研发企业,下游为医疗机构、医美机构等消费端。上游产业链相对成熟,以聚乳酸上游为例,虽然聚乳酸的生产在我国目前仍属起步阶段,已建并投产的生产线不多,且多数规模不大,但众多上市公司已涉足,如海正生材(68203.SH)、丰原生物、万华化学等。
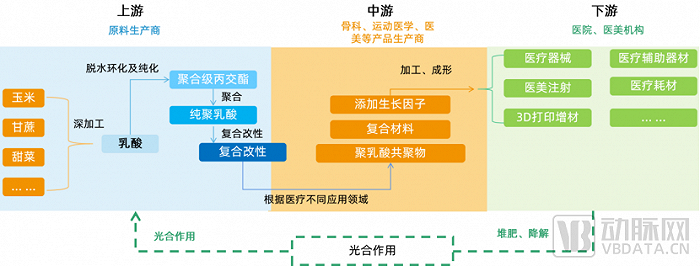
而中游企业的研发情况与产品迭代对下游医疗、医美机构市场格局影响较大。
以爱美客为例,推出聚乳酸注射产品后,2022年三季报显示,公司第三季度营收、净利分别同比增长55.15%和41.55%,销售毛利率环比微增达到94.61%。据华东医药2022年中报数据,"少女针"上半年销售额同样亮眼,约2.71亿元。
在骨科及支架领域,2020年3月由威高骨科(688161.SH)研发的具有中国自主知识产权的第四代生物可吸收心脏支架(Xinsorb)上市,此款心脏支架采用聚乳酸作为基体材料,临床试验取得良好结果。
从产业链上看,中游的医疗研发企业将不断的推动下游市场结构和格局的变迁,同时也印证研发能力是再生材料中游企业实现商业价值的重要引擎。
组织工程:中游蓬勃发展,下游类器官已开展商业化探索
组织工程领域上游为打印硬件以及耗材,设备的先进性对中游的产品解决方案顺利完成具有一定程度的影响。从上游商业化推进的方式来看,以设备联合打印材料的方式,在商业化落地上易于打开市场。中游的生物3D打印商业模式如何聚焦,巨头正积极布局。涉及中游业务的海外3家头部公司BICO、3D Systems和Desktop Metal分别选择了不同的商业路径(见报告正文),为国内生物3D打印相关企业的商业化推进起到了借鉴和参考的作用。
类器官为组织工程的下游分支之一,组织工程技术是器官再造的重要技术手段。通过蛋壳研究院的调研得知,类器官在我国目前发展阶段主要以体外微组织为主,多用于药物筛选,生物3D打印从组织打印向器官打印过渡仍需一段时间的发展及基础研究领域的不断深入。
商业化推进助力:保险机制将激发市场活力,行业标准互动加剧
再生医学商业化实现需要保险的引入,与保险合作将更大程度推广产品应用。以干细胞药物产品为例,获得批准上市,无疑是每一个新药研发者翘首以盼的终点。但要获得市场认可,更关键的因素或许还是药物的效价比。
干细胞中,销售情况最好的Temcell就享受了纳入健保给付带来的好处。Temcell来自日本,主要运用骨髓间充质干细胞,目前的价格为约12万美元/系列疗程。在JCR的财报中,Temcell的销售收入在2018年约1800万美元,2019年约2800万美元。
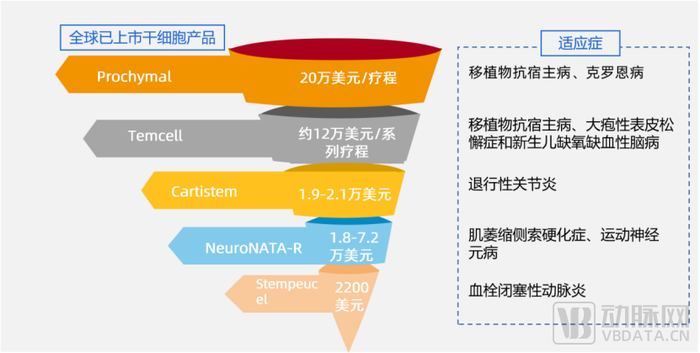
为了促进再生医疗发展,日本的再生医疗产品上市后将可纳入健康保险给付。Temcell一剂价格为868,680日元,系列疗程约1390万日元。由于健保辅助,患者只承担10-30%。
2014-2017年,Provenge、Glybera、Chondrocelect、MACI这4款细胞/基因疗法在欧盟退市或暂停,原因与安全因素无关,而是不能说服政府和保险公司为其报销费用。未来干细胞是否拥有更加广阔的市场,除技术、研发等内在因素外,政策环境、支付结构亦同样占据重要的地位。
由于再生医学的发展阶段尚属早期的属性,让行业内的从业企业可以积极参与行业标准的制定,使得企业、行业协会、监管者等多方形成高频的互动,搭建良好的信息沟通平台。
投融资
近两年,在整体投融资活动段性收缩的环境下,再生医学行业的投资仍然热情不减。我们按照干细胞技术、材料、组织工程进行分类统计。在2020年的低谷后,三个赛道均呈现出了逆势反弹的局面。
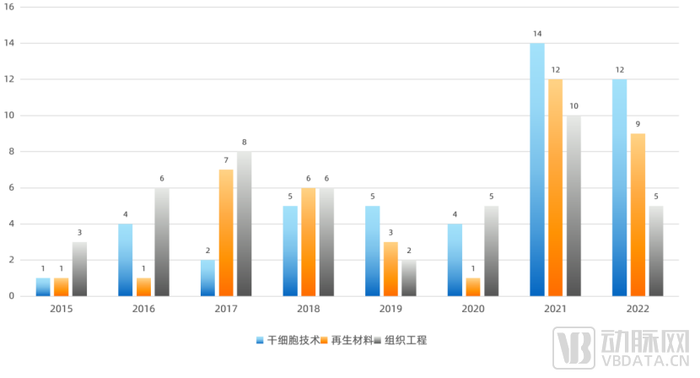
再生医学行业投融资起数按赛道统计表(2015-2022)
再生医学行业总体来看,A轮投融资事件起数在近5年的投融资中呈现出波浪式上升的趋势,从2021年创造的高点,到2022年有所回落。具体到三个领域中(请于报告正文查看再生医学各赛道融资详情),干细胞领域呈现出有别于其他两个领域的趋势,在2021、2022两年中持续上升。
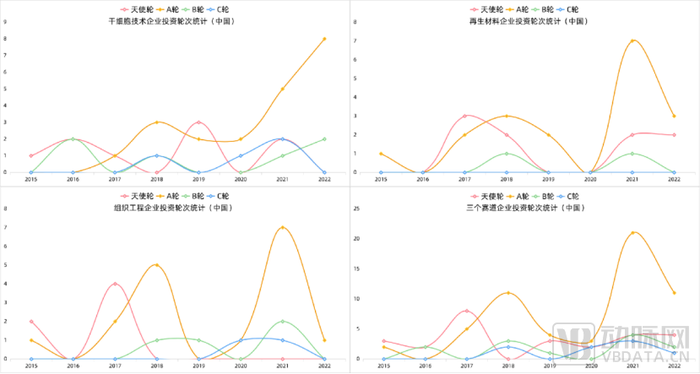
究其原因,一方面由于我国干细胞政策的陆续松动和支持,可以使得更多的科研进行临床转化,为投资机构注入了更多信心。
另一方面,从投资角度来看,CGT行业过去几年的投融资活动频繁且近年陆续收获IPO,一定程度推动了社会对于整体细胞领域的关注,同时因近两年我国干细胞领域的部分产品陆续获批进入临床,引来了嗅觉敏锐的资本关注,资本的行动总是早于市场发展状态,当免疫细胞领域已经蓬勃发展,这些日夜兼程的投资人已开始将目光开始锁定更为早期的iPSC领域。
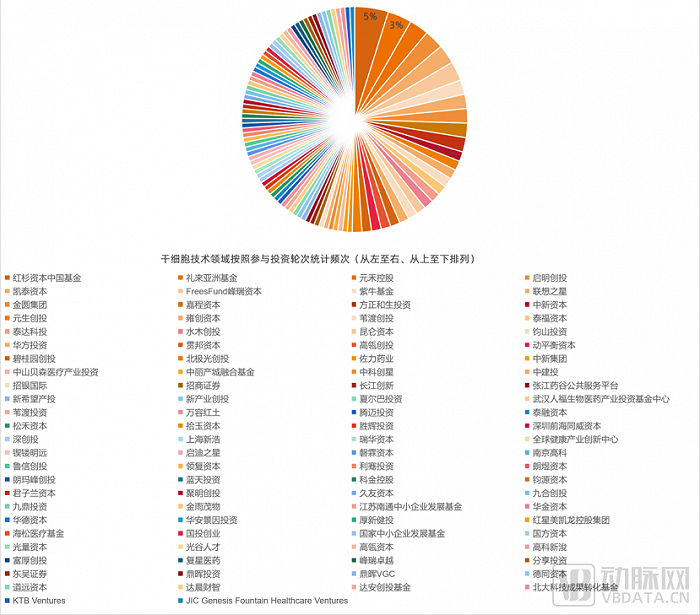
技术、人才、工艺、管理是投资机构决策的重要维度
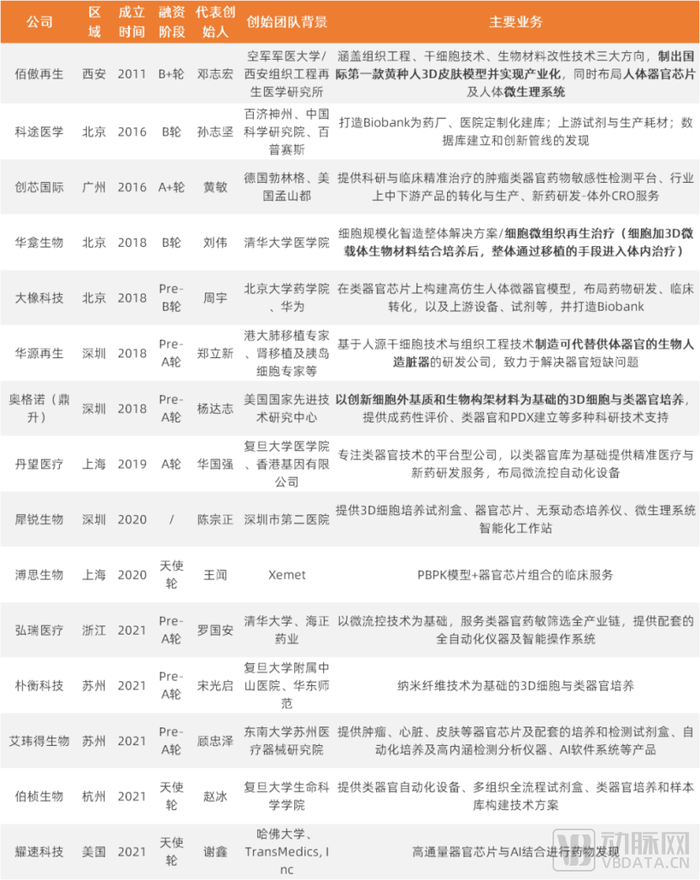
我们采访了红杉中国董事总经理顾翠萍,就投资IPSC赛道的企业而言,红杉中国看中企业的几个立体维度。
一是企业创始团队的技术背景。二是企业人才梯队的构建,以细胞治疗产品的生产为例,从少量的实验级别的生产,一直做到后续能够持续稳定的生产,需要经历繁复的步骤,在过程中需要交叉学科、综合经验背景的人才加入。三是对产品工艺的全方位理解。IPSC从技术到产品的过程中,制造工艺、生产设施等同样起着关键性的作用。四是建立完善的药品生产质量管理规范、清晰的注册路径,加快产品的临床验证,这个过程更能多维的验证企业的能力。
收购兼并,成为部分龙头再生医学企业扩张的战略方式
在细胞、材料、组织工程领域,收购行为也在频频上演。
材料领域,2022年4月,华熙生物宣布,其与中煤地质集团有限公司签署《产权交易合同》,以2.33亿元收购北京益而康生物工程有限公司51%的股权,正式进军胶原蛋白产业。8月,美妆巨头资生堂在华专项投资基金正式启动,首笔投资押注重组胶原蛋白原料公司。
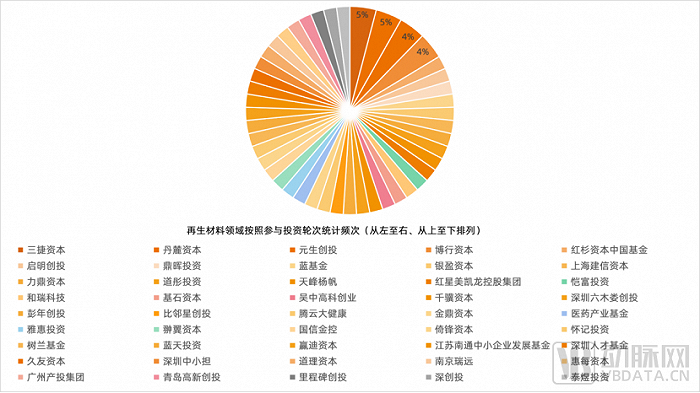
生物3D打印领域,2019年8月6日,Cellink宣布以3025万欧元收购Cytena;2020年8月,Bico以8000万欧元收购德国精密点胶公司Scienion及其子公司Cellenion,进一步掌握细胞3D打印技术;成立于1986年,由“3D打印技术之父”Chuck Hull参与创建的3D Systems(NYSE:DDD)也在通过收购、合并和扩展等方式深入涉足3D生物打印领域,其中,最重要的里程碑是在2021年5月收购了3D生物打印机开发商Allevi公司,后者拥有一套成熟的生物3D打印系统。
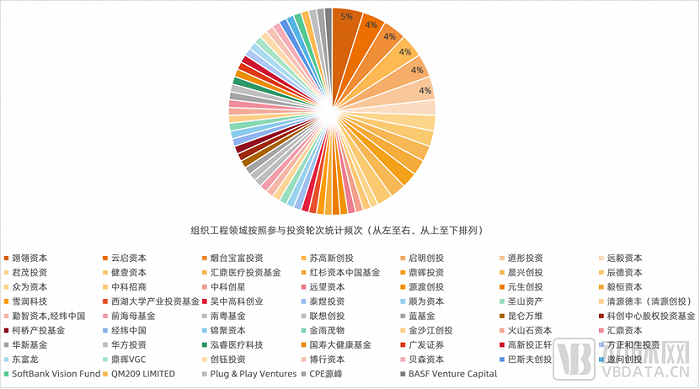
从企业接受投资的角度看,组织工程、细胞产品、再生材料相对周期长,组合多,很多目标为短期的投资机构都有资金退出的压力,对于再生医学行业的企业来说,创始团队更加欢迎投资回收周期相对长的机构进行合作。
投资机构对再生医学赛道青睐的原因之一,在于再生医学市场是在满足曾经人们在医疗中未被满足的需求,在于创造出一个新的市场,而非取代传统治疗手段市场。因此再生医学面对的是一个待开发的增量市场,这是吸引众多投资机构持续参与该赛道的巨大动力。
行业趋势
再生材料、细胞技术、组织工程三大方向将持续演绎创新增量
(1)组织工程领域具体商业化落脚点或在未来3年逐渐明晰
蛋壳研究院的调研发现,组织工程领域内的从业者普遍认为,组织工程具体在哪一个环节将获得商业化的途径,预计3年内就会有较为清晰的市场验证,同时,实现这一目标也需要行业参与者共同打通技术各阶段的发展痛点。
(2)再生材料按不同医疗应用领域进行材料改性、深度联合开发将成趋势
总体来看,再生材料的发展将呈现新旧技术融合发展的态势。同时,再生材料行业在重组胶原蛋白、复合透明质酸、聚乳酸、脱细胞基质、丝素蛋白等一系列再生材料上不断创新、研究与再生因子的结合,开发全新的材料配方和制造工艺。在全球来讲,中国也将成为新一轮材料技术领跑者。
(3)化学诱导、成体干细胞等基于全新细胞改造平台的新产品会陆续涌现
化学重编程技术具有安全简单、易于标准化、易调控等一系列技术优势,突破了部分多潜能干细胞制备技术的局限性,是下阶段细胞技术不可忽视的重要发展方向。未来还将有多种基于全新细胞改造平台的新产品会陆续涌现出来,比如化学诱导的细胞间转分化技术,以及多种成体干细胞的应用,而这些新产品都将打开再生医学细胞领域未来广阔的市场空间。
再生医学全球处于起步阶段,中国企业存在大量创新和弯道超车的机会
整体来看,再生医学全球仍然在早期,未来20年都会在成熟过程之中。在疫苗、抗体这些传统大分子,小分子领域,由于历史原因,中国处于追赶者的地位,但在CGT领域,通过对多位行业从业者及投资机构负责人调研访谈表示,由于组织工程、干细胞技术、再生材料本身的发展历史较短,且国内目前呈现蓬勃的发展态势,该领域中国与海外领先技术目前差距非常小。
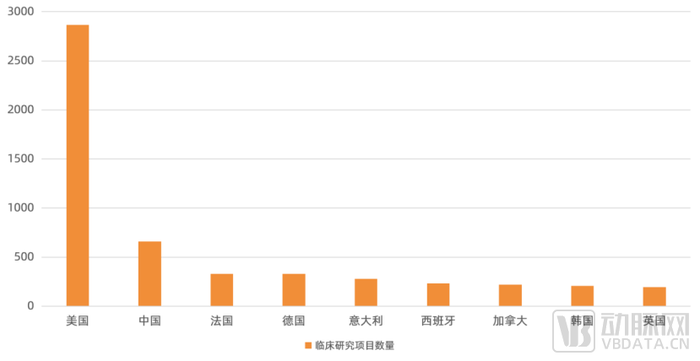
部分国家干细胞临床研究项目数量分布图
AI技术、传统医疗器械领域将向再生医学融合,类器官将产业化
(1)未来10年,超过50%的人体组织和简单类器官会出现商业化产品
根据FDA的临床数据,目前20%的人体组织已经形成了商业化的产品和销售。
另外70%的人体器官的细胞、支架进入到了II期以上的临床阶段,支架与细胞结合的器官类产品相对研发及临床时间较前两者相对更长。但可以预计未来10年,在全球范围内,超过50%的人体组织和简单性器官(包括人工肾脏、人工血管、人工胰腺等)会陆续出现商业化的产品面世、造福患者。
这一趋势需要细胞、材料、组织工程三个主要的再生医学领域融合发展才能更好的实现。目前在细胞和微载体上进行的药物试验,未来也将随着类器官的发展出现在人造组织和器官上进行试验的层面。用器官、组织来替代现在细胞承担的研究工作,这也将是行业重要的发展方向之一。
(2)传统医疗器械、AI技术等细分领域将逐渐向再生医学行业延伸、融合
未来,将有越来越多曾经的植入性医疗器械,即纯替代性的医疗器械产品,开始叠加组织刺激、再生修复的技术,合成为以再生修复为目标的医疗器械产品。
同时,再生医学整个产业链会在未来逐步展开,将会出现大量、优质的细分领域机会,也会出现很多颠覆现有构架的技术,与再生医学行业进行融合发展。例如AI辅助药物发现目前是成熟的商业模式,将AI的技术引入到细胞工业、材料技术及配方、组织工程的设计等方面,会产生多维碰撞,将极大的促进再生医学的整体发展。
再生医学若干细分领域申报路径有待明晰,伦理亦将影响行业发展
由于再生医学领域的创新性特点和整个产业的新兴态势,在规则、规范方面,全球均处于起步的阶段。目前部分细分领域申报路径,法规上相对不够明确,例如细胞培养基行业依然没有完善的质量监管体系,国内企业通过DMF备案、GMP管理体系认证、ISO认证、医疗器械认证、质量审计情况等方面来论证自己的完善质量体系。
但调研中众多受访者也表示,CDE的学习速度非常快,如何能够制定出就是比较适合国内的这个标准、适合我国国情的监管规则,通过与行业研究人员、企业的密切沟通,同时随着美国产品越来越多的IND批准,国内的监管的开放度、明确度、清晰度,均在快速地进步,法规的逐步明晰将成为必然。
而在再生材料领域,监管将趋于严格。国家无论是对于新材料标准的制定,还是新法规的发布,包括监管指导原则等,目前正将行业内曾经不太明确的要求清晰化,某种程度上也将行业的门槛进行了提高。对于企业来讲,这种门槛的提升将会淘汰一批企业,进一步促进还在局中的玩家进行技术迭代、产品创新。
此外,伦理将在一定程度影响行业发展。比起传统领域,再生医学领域将在伦理上引发参与各方以及社会民众更多的探讨。
就像克隆羊多莉羊带来的社会广泛影响已经超越了克隆技术本身,人们用不同的视角讨论克隆人的伦理问题,引发了激烈的社会讨论。同样存在人体组织复制路径的再生医学未来能够在多大程度上于临床实现应用,伦理的讨论也将在一定程度上影响行业的发展。
从某种意义上来说,再生医学的崛起开辟了疾病治疗崭新的道路,它的意义不仅在于为解除患者痛苦提供了一种新的治疗方法,更主要的是提出了激活、复制、重生“组织”和“器官”,焕新人体免疫机制的新思想。
毫无疑问,“再生医学的新时代”已经到来,而这是一场“深远的医学革命”。




评论