文|i美妆头条 姚立凡
编辑|黄友枝
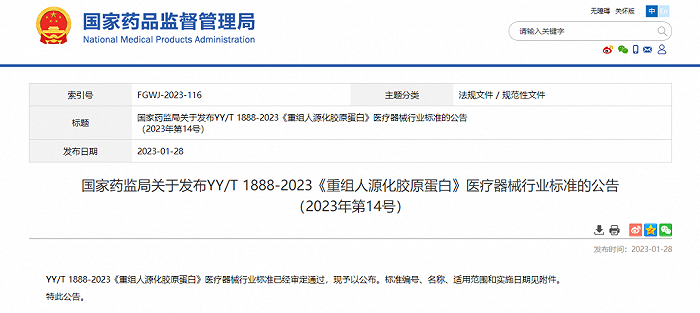
1月28日,国家药监局发布公告称,YY/T 1888-2023《重组人源化胶原蛋白》医疗器械行业标准已审核通过,并将于2023年7月20日实施。该标准规定了重组人源化胶原蛋白的质量控制、技术要求、试验方法、稳定性、生物学评价以及包装、运输和贮存等。
另外,2023年1月29日,国家药品监督管理局医疗器械标准管理中心发布了《重组胶原蛋白生物材料命名指导原则》解读,以更好地指导和规范重组胶原蛋白医疗器械的命名工作。

两则重组胶原蛋白文件的发布,不仅传递出国家层面对于重组胶原蛋白在医疗、护肤等行业应用的认可,也将为重组胶原蛋白行业带来更加规范化、标准化发展的引导。
01、重组胶原蛋白异军突起
从动物源胶原蛋白到重组胶原蛋白,在科研力量的驱动下,胶原蛋白行业迎来新的突破与发展,重组胶原蛋白成为更优质、更有应用发展前景的新型胶原蛋白材料。化妆品市场的聚光灯也再次投向了重组胶原蛋白这条潜在的高景气赛道。
众所周知,胶原蛋白(Collagen)作为一种功效蛋白质,在化妆品中起到抗皱、修护皮肤屏障、保湿等作用,在美容护肤和大健康领域都备受关注。哈佛医学院麻省总医院皮肤生物学研究中心研究员陈宏翔教授就曾公开表示,皮肤的衰老本质就是胶原蛋白的流失,在皮肤中I型胶原蛋白占85%,Ⅲ型胶原蛋白占比10%-15%,胶原蛋白的补充对于延缓皮肤衰老有着至关重要的作用。
而以往的胶原蛋白来源主要是以动物源为主,存在着潜在的排异风险和病毒隐患。随着合成生物学的发展与进步,胶原蛋白在基因重组技术上的突破,重组胶原蛋白问世,成为更优质、更有应用发展前景的新型胶原蛋白材料。
资料显示,重组胶原蛋白是利用DNA重组技术制备的胶原蛋白,其氨基酸序列可根据需求进行设计改进,如重组人源化胶原蛋白的重复单元与人胶原蛋白氨基酸序列特定功能区相同。这种制备方式可实现定制化合成,即不仅可合成不同类型的胶原,还可筛选出不同型别胶原分子上的特定功能区并根据需要进行定制组合。
由于重组胶原蛋白的序列与人体的基因序列高度一致,组织相容性较好,可以被人体直接吸收并参与构建胶原蛋白,具有生物活性及生物相容性更高、免疫原性更低、病原体隐患风险更低、水溶性更佳、无细胞毒性、可进一步加工优化以及更容易运输和储存等多种优势。截至目前,国际上已有230余项临床研究和学术文献证明重组胶原蛋白的优秀性能。
巨子生物研发总监王小军告诉美妆头条,伴随着生物科技的迅速发展,尤其是国内重组胶原蛋白产业化和应用研究已经达到国际领先水平,现有研究结果证实重组胶原蛋白安全性高、生物学功效确切,是能够应用于多个领域的生物活性成分,加之消费者消费升级,对于产品的安全性和有效性均提出了更高要求,因此重组胶原蛋白备受追捧。
在他看来,随着越来越多以重组胶原蛋白为原料的产品推出并在市场上赢得良好口碑,重组胶原蛋白将迎来高速发展的黄金时期。
弗若斯特沙利文数据预测,2022-2027年,我国重组胶原蛋白产品的市场规模将以42.4%的复合年增长率从185亿元增至1083亿元,高于动物源胶原蛋白25.3%的增速。
02、市场规范化,重组胶原蛋白行业标准出炉
伴随着重组胶原蛋白赛道入局者越来越多,难免会有虚假宣称、概念添加等泥沙俱下的乱象。为进一步规范胶原蛋白市场,国家药监局先后颁布了多项行业标准及政策,分别对重组胶原蛋白生物材料命名、产品监督管理及质量控制等作出规范要求。
例如,目前市场上存在重组胶原蛋白宣传不规范的行为,比如使用“全人源重组胶原蛋白”、“去端重组胶原蛋白”以及“类人(源)重组胶原蛋白”等不规范用语。
为解决行业存在的不规范用语现象,2021年3月,国家药监局发布的《重组胶原蛋白生物材料命名指导原则》提到,重组胶原蛋白生物材料名称由核心词和特征词组成,按“特征词(如有)+核心词(A+B)”结构编制。
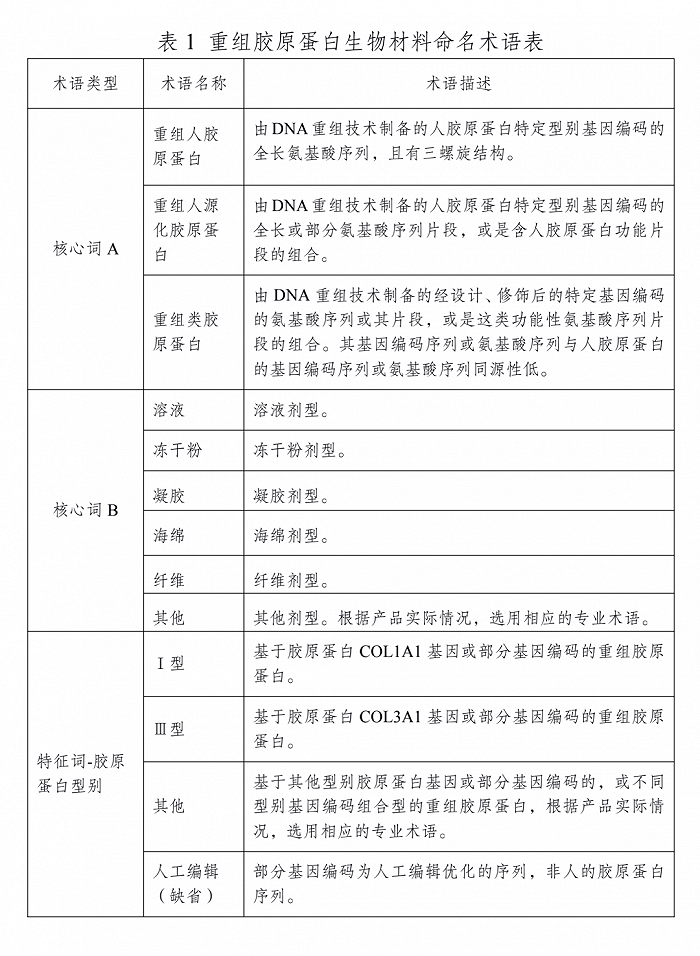
根据《指导原则》,A项核心词只有3个,包括“重组人胶原蛋白”“重组人源化胶原蛋白”“重组类胶原蛋白”。B项核心词包括:溶液、冻干粉、凝胶、海绵、纤维、其他。特征词则有Ⅰ型、Ⅲ型、其他。
值得一提的是,2023年1月29日,国家药品监督管理局医疗器械标准管理中心发布了《重组胶原蛋白生物材料命名指导原则》解读,以更好地指导和规范重组胶原蛋白医疗器械的命名工作。

重源品牌市场经理凌诗雅坦言道:“重组胶原蛋白行业是新兴行业,很热闹,也很不规范,甚至很多业内人士对于重组胶原的命名规则都不甚了解,尤其是目前重组胶原大量被应用在医美领域,这事关消费者的生命安全和整个行业的发展前景,所以相关部门尽早介入,持续更新行业标准,也是为了更好地规范乱象。”
她认为,重组胶原蛋白行业标准的建立和实施,代表了国家层面对于重组胶原蛋白在医疗、护肤等行业应用的认可,行业标准的出炉从初期也能够帮助真正做科研、搞技术、符合安全标准的企业走得更长久,整个行业发展得更健康。
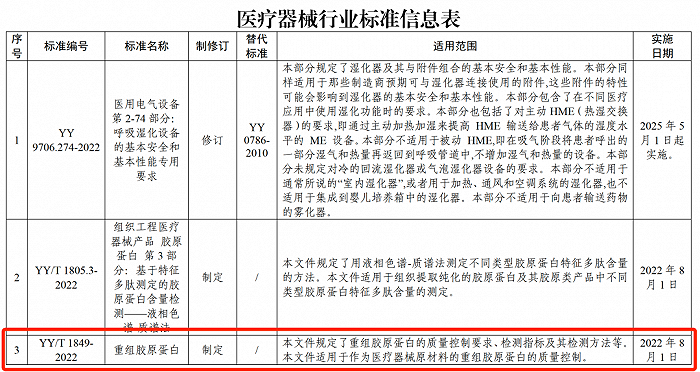
为进一步规范胶原蛋白市场,2022年1月13日,国家药品监督管理局发布了《重组胶原蛋白》(YY/T 1849-2022)行业标准,并已于2022年8月1日正式实施。该标准规定了重组胶原蛋白的质量控制要求、检测指标及其检测方法等,适用于作为医疗器械原材料的重组胶原蛋白的质量控制。
这份文件的发布,是国家首次针对重组胶原蛋白在医药领域出台的行业标准,既代表了国家层面对于重组胶原蛋白在医疗、护肤等行业应用的认可,也将在很大程度上引导重组胶原蛋白的规范化、标准化发展。
2022年4月,国家药监局综合司发布关于《重组人源化胶原蛋白》医疗器械行业标准立项的通知,行业标准制定的主要出发点是为鼓励重组人源化胶原蛋白新型生物材料研发创新,推动医疗器械产业高质量发展。
2023年1月28日,国家药监局发布公告称,YY/T 1888-2023《重组人源化胶原蛋白》医疗器械行业标准目前已审核通过,并将于2023年7月20日实施。此次新规发布也将为行业带来更加正向的引导。
“新出台的标准还是基于《重组胶原蛋白》的行业标准,基本内容一致,是对于重组人源化胶原蛋白做为医疗器械原材料的质量要求进行了细化要求。”王小军认为,未来还会有针对化妆品甚至是食品的重组胶原蛋白相关标准出台,这反映了国内企业对于重组胶原蛋白的开发研究进入了快车道,应用场景也会越来越多,行业发展趋于规范,门槛变高,对于头部企业的发展是重大利好。
03、重组赛道白热化,资本与企业急速狂飙
此次行业标准的正式实施,胶原蛋白行业越来越规范化的同时,竞争也越发激烈,前有巨子生物、锦波生物、创尔生物,后有华熙生物、江苏吴中等纷纷入局,资生堂在中国的首投也选择了中国胶原蛋白企业创健医疗,持续扩大的胶原蛋白赛道,不断地上演着风起云涌地较量和争夺。
港交所上市的巨子生物,早在2000年,在全球范围内率先实现重组胶原蛋白科研成果转化及产业化,也是全球范围内拥有最大重组胶原蛋白产能的企业之一。据巨子生物的招股书显示,其2021年重组胶原蛋白产能达到10.9吨,并计划于2023年扩展超过200吨。目前巨子生物自主研发的多款基于重组胶原蛋白的Ⅲ类医疗器械产品已进入临床试验阶段。
与此同时,巨子生物已经构建起了一个重组胶原蛋白分子库,“分子库”中已储备的33种不同类型的重组胶原蛋白,包括3种全长Ⅰ、Ⅱ、Ⅲ型重组胶原蛋白,5种重组胶原蛋白功效片段,25种功能强化型重组胶原蛋白。
头部玩家锦波生物则通过对天然人源胶原蛋白序列进行重复拼接,开发了一种基于III型胶原蛋白的重组人源化胶原蛋白。自主研发的三类医疗器械“重组Ⅲ型人源化胶原蛋白冻干纤维”与其核心品牌“薇旖美”于2021年6月获得国家药监局批准上市,是国内唯一获批的可注射重组人源化胶原蛋白产品。
透明质酸巨头华熙生物在2022年年底表示,其近年加大投入合成生物,胶原蛋白项目年底可以实现化妆品级的量产,并将胶原蛋白视为继透明质酸之后的第二大战略性生物活性物。目前,华熙生物在胶原蛋白领域已全线布局重组人源胶原蛋白、动物源胶原蛋白、水解胶原蛋白(肽)三大细分领域。
老牌美妆企业丸美股份携手暨南大学基因工程研究院,推出美丽法则与丸美胶原蛋白次抛等新型产品。值得一提的是,丸美股份举办第二届重组胶原蛋白抗衰老论坛,发布一系列重组胶原蛋白研究成果,将持续投入亿元资金,展开对重组胶原蛋白未来长达十年的研究。
此外,在其他潜在玩家中,暨源生物同样在布局重组人源化胶原蛋白、重组类人胶原蛋白的研发生产;国际化妆品巨头资生堂也在2022年投资了专注于重组胶原蛋白研发的创健医疗,加速推进重组胶原蛋白生物材料创新发展……
重组胶原蛋白赛道火热异常的同时,我们也要看到,目前重组胶原蛋白市场仍处于技术成本高,产业化规模仍较低的局面,重组胶原蛋白可量产和应用的种类还不够多,多种类型重组胶原蛋白的生物活性和作用机理等还有待进一步深入研究。
暨南大学教授熊盛就曾公开表示:“生产制造难,结构设计、功能仿生难,生物学活性表征难,行业标准不规范等都是这一领域不容忽视的问题。”并直言,生产成本是重组胶原蛋白领域不得不面对的难题。不同于玻尿酸,目前重组胶原蛋白生产成本依然居高不下,产业化规模仍有待持续扩大,市场期待活性更强、性价比更高的重组胶原蛋白的广泛应用。
有业内人士透露,60%-90%纯度的重组胶原蛋白,价格在每公斤十几万以上,纯度100%胶原蛋白市场价格可能去到每公斤超百万元。
此外,教育成本高,接受门槛高也是重组胶原蛋白现阶段需要解决的难题。凌诗雅表示,重组胶原蛋白需要教育和科普的内容相当多,短时间很难触达消费者的认知。另外重组人源化胶原蛋白它不是填充材料,而是再生材料,短时间内很难让消费者快速看到变化,同时也因为技术门槛高,价格相应也会比较高,所以很难快速击穿消费者决策。
那么,作为下一个能支撑起某个产业规模化增长的热门原料成分,重组胶原蛋白又该如何突破技术成本高,产业化规模仍较低的局面呢?
在王小军看来,重组胶原蛋白发展需要从横纵两大方向进行突破。首先是横向,要求研发人员开发出更多种类型具有不同功能的重组胶原蛋白并产业化,同时根据新型重组胶原蛋白的功能和分子量等特性应用于不同领域,进一步拓展其应用场景。
他表示,由于不同类型的重组胶原蛋白的生产难度差异较大,比如全长α链的生产就比片段型或拼接型难度大很多,所以具有先行优势和投入更多研发力量的企业将会赢得先机。
第二是纵向,对于每一种重组胶原蛋白的功效进行验证并深入研究其作用机制,为各类产品的开发提供理论依据,为企业筑起了一道坚固的“护城河”。
正是由于还有更多需要攻关的技术瓶颈,重组胶原蛋白市场方兴未艾,才能激发更多的资本与企业去掘金,更深入地布局这一赛道。可以肯定的是,借助新标准、新政策、新方向,重组胶原蛋白市场的发展将迎来一个新的时代。
监制 | 陈山花



评论