文 | 财健道 吴妮
编辑 | 杨中旭
5月24日开盘,君实生物(688180.SH/01877.HK)在A股和港股的股价双双跳水,A股一度触及跌停,港股现跌超12%。
难以想象,君实的大跌源于一个“好消息”——5月23日晚间,君实生物发布《上海君实生物医药科技股份有限公司关于 VV116 对比 PAXLOVID 早期治疗轻中度COVID-19的III期注册临床研究达到主要研究终点的公告》(以下简称“公告”),称其与旺山旺水合作开发的新冠口服药VV116,在一项对比辉瑞口服药PAXLOVID用于轻中度新冠早期治疗的III期注册临床研究(NCT05341609)上,达到方案预设的主要终点。

关注新冠口服药的人可能还记得,4月6日开拓药业(09939.HK)公布普克鲁胺“相应保护率为100%”,当日股价上涨106.37%的盛况。那为何君实公布III期临床成功的结果后,会被资本的巨浪拍在沙滩上呢?
浩悦资本资深合伙人李逸石表示,股市会对此前公开和甚至不公开的消息进行预期和计价(price in),如果企业的新动向没有达到预期,市场就会以下跌作为反馈。
如果没有官宣,市场就还持有更好的预期;一旦官宣,意味着预期破灭。而股价是预期的折现。
目前国产新冠口服药处于冲刺阶段的有三家,真实生物的阿兹夫定、开拓药业的普克鲁胺以及君实生物的VV116。对于三者之中谁会最先撞线的问题,一直争论不断。而这次《公告》给君实的支持者浇了一盆冷水。
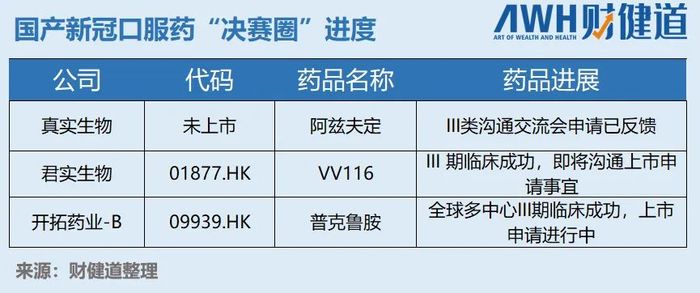
君实在《公告》中表明公司将于近期与监管部门沟通递交新药上市申请事宜,结合NMPA公开信息,可以得知君实才进展到II类会议,且尚未得到反馈。
开沟通交流会意味着什么?
国家药监局药品审评中心于2020年12月10日发布了《药物研发与技术审评沟通交流管理办法》。在该办法中,对沟通交流进行了定义,即沟通交流是指在药物研发与注册申请技术审评过程中,申请人与药审中心审评团队就现行药物研发与评价指南不能涵盖的关键技术等问题所进行的沟通交流。其中,沟通交流会议根据不同的情况分为Ⅰ类、Ⅱ类和Ⅲ类会议。
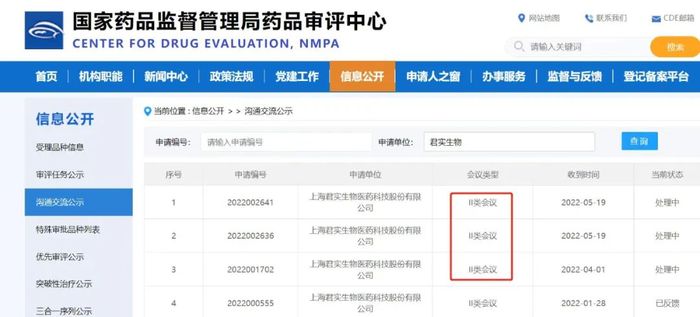
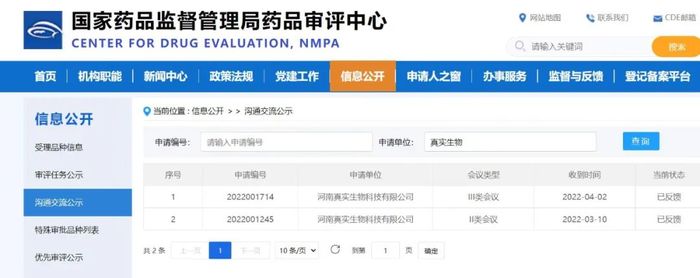
虽然君实新药作为新药,可能不需要III类会议,但依然被真实生物拉开了一个多月的进度。
真实生物早于4月2日得到了III类会议的反馈。再加上,真实生物为阿兹夫定接连签下三家生产经销商,“首个国产抗病毒阿兹夫定即将在平顶山投产”等消息释出,让阿兹夫定看起来已经冲刺在即了。
来自开拓药业的压力也不小。开拓药业负责人日前证实,国家药监局正在审理普克鲁胺新冠适应症的上市申请。
如果说,君实在审批速度上有什么优势的话,可能是与辉瑞Paxlovid的头对头试验。头对头试验可以直接检验药效, 对审核有巨大推动作用。
在业内人士刘超看来,对新冠口服药这种战略型产品来说,在辉瑞Paxlovid引入中国市场后,相应地,国内审批至少会再批准3家新冠口服药。所以说三者的胜负不能根据速度下定论,疗效和安全才是最重要的。
那么问题又来了,VV116能够凭借有效性和安全性反超吗?
本次《公告》临床研究结果显示,VV116用于轻中度COVID-19的早期治疗达到临床方案预设的主终点。然而,君实选取的主要终点,并非CDE的指导原则下最优的评价——降低重型/危重型和死亡发生率指标,而是“至持续临床恢复的时间”——即受试者的新冠病毒转阴时间。
《公告》里没有披露临床数据,但5月17日,君实在Emerging Microbes &Infections 期刊上曾初步评价了轻症奥密克戎感染患者核酸转阴这单一指标。研究数据提示,在首次核酸检测阳性5日内使用VV116的奥密克戎感染患者,其核酸转阴时间为8.56天,小于对照组的11.13天。
在新药研发从业者周叶斌博士看来,这个数据远远不够。核酸转阴时间缩短反应的是载毒量下降更快,但抗病毒药更关键的是对疾病的治疗作用,比如转重症的比例是否下降。而且,降低重症风险也是辉瑞口服药在临床试验里体现出来的作用,要与辉瑞口服药比较非劣性,也要从这一点出发。
君实这波属于田忌赛马了。
业内对于VV116的其他质疑也都与临床数据相关。《公告》里提出的次要研究终点,即重症改善情况,被市场普遍认为是VV116获批上市的关键。VV116能否达到这一研究终点?国际多中心临床研究数据又如何?
历史总是惊人的相似。开拓药业于4月6日公布临床III期试验关键数据时,也饱受争议。公告中,相比此前更常见的治愈率、致死率、阻断率等等,开拓药业更多地使用“保护率”这一词。业内人指出,开拓药业可以自行定义“保护率”这个词的用法,但通常来说,还是要去跟国际药厂或者现有新冠口服药做头对头的对比,从减少危重症,减少住院或死亡率等常规数据角度进行比较。100%这一数据也让医学界、投资界为之警觉。
对于君实与开拓来说,最好的回应,是更多的临床数据和真实世界的验证。
上下游产业早已摩拳擦掌,疫情中的人们也翘首以盼,希望国产口服药能够不负众望。
(作者系《财经》研究员)
制图 | 李紫雅
参考文献
【1】市场关注普克鲁胺热度不减 开拓药业回应股东权益变动披露.投研电讯.2022.5.20
【2】最新解读:从君实V116公告看国产新冠药的真实进度!.财经星星眼.2022.5.24
【3】21医政解读|助推药企真创新力度再升级,CDE新政为突破性治疗药物审评加速度.21世纪经济报道.季媛媛.2022.2.24
【4】最新研究!我国研发的这款口服抗新冠药物,对部分非重症奥密克戎感染患者,或能缩短核酸转阴时间.每日经济新闻.2022.5.18



评论