文|氨基观察
在BD方面,恒瑞医药终于等来了好消息。
11月9日,璎黎药业PI3Kδ抑制剂获NMPA批准上市,用于既往接受过至少两种系统性治疗的复发或难治滤泡性淋巴瘤成人患者。
恒瑞医药拥有该PI3Kδ抑制剂中国地区的独家商业化权益,因此是最大的受益者。
不过,恒瑞医药或许还没到彻底舒气的时候。
在海外,PI3Kδ抑制剂的处境并不好过。因为无法带来总生存期优势,今年以来FDA对于PI3K抑制剂的态度不断缩紧:
先是对PI3Kδ抑制剂凭借单臂临床上市的做法说不,后又对已经上市PI3K抑制剂的适应症价值给予否定。
这种情况下,国产PI3Kδ抑制剂的表现将会如何呢?
01 恒瑞最早的BD之一
从时间节点来看,PI3Kδ抑制剂称得上是恒瑞医药发力BD的标志之一。
早在去年2月8日,恒瑞医药就以入股的形式,获得了璎黎药业PI3Kδ抑制剂YY-20394,中国地区的联合开发权益以及排他性独家商业化权益
这笔交易对于当时的恒瑞医药来说,已经是“大手笔”:入股资金为2000万美元,并且后续还需要承担不菲的两项费用。
一项为研发费用。YY-20394在被恒瑞医药引进之后开展的临床,恒瑞医药需要支付50%的研发费用。
另一项为里程碑款:YY-20394每获批一项适应症,恒瑞医药需要支付1000万元里程碑款,总计不超过3000万元。
在BD领域出手并不多的恒瑞医药,愿意“重金”引进YY-20394也不奇怪。
PI3K-AKT-mTOR信号通路能够控制多个细胞过程,包括代谢、运动、增殖、生长和存活,其异常激活会为癌细胞提供便利,几乎介导了50%恶性肿瘤的发生。
因而,切断这一信号通路来控制癌症发生,成了理想的癌症治疗靶点,且具有可观的想象空间。一方面,PI3Kδ抑制剂可直接作用于淋巴瘤细胞,抑制 Akt 磷酸化,诱导细胞凋亡;
另一方面,其亦可通过影响肿瘤免疫环境,降低Treg细胞功能,增强CD8+T细胞活性,从而杀死实体瘤细胞。
基于此,海外药企的研发如火如荼,国内入局者也不少,包括璎黎药业、石药集团、正大天晴、信达生物、圣和药业、和记黄埔等。
在这一背景下,尚未在该领域布局的恒瑞医药,引进一款PI3Kδ抑制剂自然在情理之中。
02 胜算较大的“赌局”
就当时来说,恒瑞医药这笔引进的胜算或许并不小。
虽然YY-20394最早的临床进度,仅处于2期阶段,但PI3K靶点的可成药性已经过充分的验证。
早在1988年,科学家们就发现了PI3K信号通路,随后通过数十年的研究,对于PI3K所调控信号通路的机制已经很清晰。
并且,海外众多药企,已经用“扎实”的数据,验证了PI3Kδ抑制剂具有较好的客观缓解率。
2014年,吉利德的PI3Kδ抑制剂idelalisib与安慰剂分别联合美罗华,治疗复发慢性淋巴细胞白血病(R-CLL)三期临床结果出炉:
Idelalisib组的ORR(客观缓解率)为81%,安慰剂组仅为13%,这意味着十个患者中八个都能出现肿瘤缩小,而在安慰剂组仅有一名患者出现反应。
基于这一优异的表现idelalisib率先上市,成为全球首个PI3Kδ抑制剂。
不仅是idelalisib,如下图所示,另外几款PI3Kδ抑制剂,在客观缓解率和无进展生存期上的表现也堪称亮眼。Duvelisib获批上市的适应症中,客观缓解率也是高达78%。
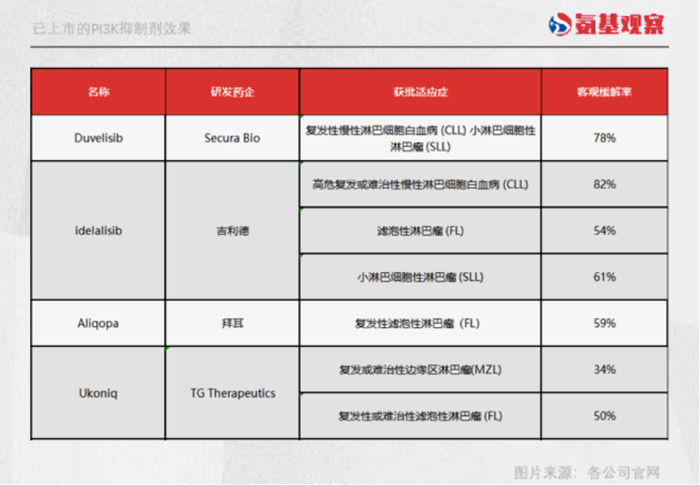
事后来看,YY-20394的客观缓解率,也没有让恒瑞医药失望。
在2022年公布的YY-20394治疗R/R FL患者,的中国II期临床试验最新数据中显示 :总缓解率(ORR)为79.8%,疾病控制率(DCR)为96.6%,12个月总生存(OS)率为91.4%。
从临床数据来看,YY-20394似乎不比海外产品差。也正是基于较高的缓解率和控制率数据,YY-20394被加速审批上市。
这一结果,无疑宣示着,恒瑞医药“赌对了”。张连山表示:该产品的上市不仅可以进一步丰富恒瑞医药的血液肿瘤产品管线,也可与公司现有产品进行联用探索。
03 盲盒只开了一半
不过,严格意义上,恒瑞医药的PI3Kδ抑制剂盲盒,还只开了一半。
客观缓解率数据与总生存期获益情况并不完全对等,所以只是“替代标准”。过去的经验告诉我们,“替代标准”不一定靠谱。部分PI3Kδ抑制剂,就不能延长患者的生存期。
今年9月23日,FDA召开的肿瘤药物咨询会,便因此以压倒性的投票数据,反对PI3K抑制剂Duvelisib用于复发或难治性慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)。
原因在于,Duvelisib遭遇OS数据不佳的困境。在名为DUO的临床试验中,使用Duvelisib治疗的患者中位生存期为52.3个月,使用Ofatumumab治疗的患者中位生存期为63.3个月。治疗组生存获益情况还不如对照组,这显然有点拉垮。
看到这里,你或许会感到疑惑,为什么PI3Kδ抑制剂客观缓解率超高,却没能延长患者生存期呢?
答案或许是,火力太猛。
由于PI3K在细胞中广泛存在,要想达到抑制肿瘤的效果,就需要加大药物剂量。但与此同时,大剂量地对PI3K一刀切,势必会影响到其他细胞的正常作用,带来严重的副作用。
可以看到,Duvelisib组不良事件发生率高达15%,而Ofatumumab仅为3%。也就是说,Duvelisib对抗肿瘤用的是杀敌一百自损三千的招数,肿瘤消失了患者的身体也垮了。
显然,这并非一款优秀抗肿瘤药物所具备的特点,也是如此,FDA肿瘤药物咨询委员会的投票结果,以压倒性的数据反对Duvelisib获批的适应症继续上市。
这不仅是Duvelisib的困境,也是大部分PI3Kδ抑制剂面临的困扰。基于此,今年以来FDA对于PI3Kδ抑制剂的态度不断缩紧。
回到国内来说,国产PI3Kδ抑制剂也要面对这些问题。比如,YY-20394在获得优先审批之后,还需要继续临床以证明药效,如果OS数据不及预期,那么或许就会重蹈覆辙。
那么,国产PI3Kδ抑制剂,会避免这一尴尬吗?



评论